摘要:1.图l2―1表示常见的垃圾分类.废弃的塑料矿泉水瓶属于
网址:http://m.1010jiajiao.com/timu_id_904179[举报]
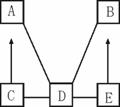
A、B、C、D、E是初中化学中常见的不同类别的物质(物质按单质、氧化物、酸、碱、盐分类)。已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐。图中“—”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去)。回答下列问题:
(1)写出下列物质的化学式:A ,E 。
(2)由E转化为B的化学方程式为 ;由C转化为A的原理在工业上常用于 。

A、B、C、D、E是初中化学中常见的不同类别的物质(物质按单质、氧化物、酸、碱、盐分类)。已知A是单质;C是红棕色固体;E是水溶液可使酚酞试液变为红色的盐。图中“—”表示相连的物质两两之间可以发生反应,“→”表示由某一物质可制得另一物质(部分反应物、生成物及反应条件已略去)。回答下列问题:
(1)写出下列物质的化学式:A ,E 。
(2)由E转化为B的化学方程式为 ;由C转化为A的原理在工业上常用于 。
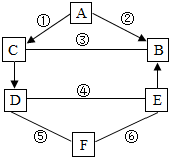 (2012?黄冈模拟)A、B、C、D、E、F都是初中化学常见的物质,其中B是植物进行光合作用的一种重要原料、C是金属氧化物.它们之间的关系如右图所示.(图中“一”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,有关反应条件和其他物质已略去.)
(2012?黄冈模拟)A、B、C、D、E、F都是初中化学常见的物质,其中B是植物进行光合作用的一种重要原料、C是金属氧化物.它们之间的关系如右图所示.(图中“一”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系,有关反应条件和其他物质已略去.)(1)已知反应①、②、③的基本反应类型相同,反应①的化学方程式为
2Ca+O2═2CaO
2Ca+O2═2CaO
;反应②的化学方程式为C+O2
CO2
| ||
C+O2
CO2
.
| ||
(2)已知反应④、⑤、⑥中,一个有沉淀生成,另一个有气体生成,还有一个没有明显现象.B、E不含相同元素,D、F只含一种相同元素.
反应⑤的化学方程式为
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
,反应⑥的化学方程式为
Na2CO3+2HCl=2NaCl+H2O+CO2↑
Na2CO3+2HCl=2NaCl+H2O+CO2↑
.
人类的生活离不开金属,用我们学到的化学知识和方法能分析和解释许多现象.
(1)常见的三种金属被发现、使用的先后顺序依次为:铜、铁、铝.金属大规模被使用的先后顺序跟下列 (填序号,下同)选项关系最大.
①地壳中金属元素的含量 ②金属的导电性 ③金属的活动性
(2)下面是甲、乙、丙、丁四种常见金属与盐酸反应的比较示意图.以下说法错误的是 .
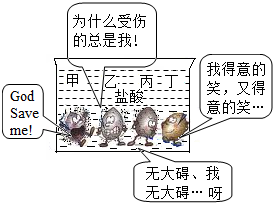
①可将上述四种金属分为两类:一类能与盐酸反应,一类不能与盐酸反应
②金属甲、乙、丙与盐酸的反应属于置换反应
③若乙是金属Zn,则丙可能是Fe或Cu
④四种金属的活动性强弱顺序为:甲>乙>丙>丁
(3)颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”.实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2发生置换反应,生成“纳米铁”,其化学方程式为 ,反应中需要保护气的原因是 .
(4)向一定量的铁粉中逐滴加入稀硫酸至过量,如图是反应过程中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示 .
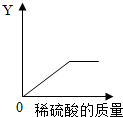
①消耗铁粉的质量 ②生成硫酸亚铁的质量 ③溶液的总质量 ④生成氢气的质量
(5)印刷铜制电路板的“腐蚀液”为FeCl3溶液.已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2.现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是 .
①溶液中一定含FeCl3,固体一定是铁和铜 ②溶液中一定含FeCl2,固体一定含铜
③溶液中一定含FeCl2、CuCl2,固体一定含铜 ④溶液中一定含FeCl2,固体一定是铁和铜. 查看习题详情和答案>>
(1)常见的三种金属被发现、使用的先后顺序依次为:铜、铁、铝.金属大规模被使用的先后顺序跟下列
①地壳中金属元素的含量 ②金属的导电性 ③金属的活动性
(2)下面是甲、乙、丙、丁四种常见金属与盐酸反应的比较示意图.以下说法错误的是

①可将上述四种金属分为两类:一类能与盐酸反应,一类不能与盐酸反应
②金属甲、乙、丙与盐酸的反应属于置换反应
③若乙是金属Zn,则丙可能是Fe或Cu
④四种金属的活动性强弱顺序为:甲>乙>丙>丁
(3)颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”.实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2发生置换反应,生成“纳米铁”,其化学方程式为
(4)向一定量的铁粉中逐滴加入稀硫酸至过量,如图是反应过程中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示

①消耗铁粉的质量 ②生成硫酸亚铁的质量 ③溶液的总质量 ④生成氢气的质量
(5)印刷铜制电路板的“腐蚀液”为FeCl3溶液.已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2.现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是
①溶液中一定含FeCl3,固体一定是铁和铜 ②溶液中一定含FeCl2,固体一定含铜
③溶液中一定含FeCl2、CuCl2,固体一定含铜 ④溶液中一定含FeCl2,固体一定是铁和铜. 查看习题详情和答案>>
 (2013?南京二模)A~F为初中常见的六种物质,它们的相对分子质量依次增大,A是六大营养素之一,F中氧元素的质量分数为30%,呈红色.相互之间的关系如图所示(图中弧线表示两端的物质能发生化学反应;箭头表示物质间存在转化关系.部分反应物或生成物以及反应条件已略去):
(2013?南京二模)A~F为初中常见的六种物质,它们的相对分子质量依次增大,A是六大营养素之一,F中氧元素的质量分数为30%,呈红色.相互之间的关系如图所示(图中弧线表示两端的物质能发生化学反应;箭头表示物质间存在转化关系.部分反应物或生成物以及反应条件已略去):(1)F的化学式
Fe2O3
Fe2O3
(2)C物质类别属于
氧化物
氧化物
(选填“氧化物、酸、碱、盐”)(3)写出下列反应的化学方程式:B→A:
2H2+O2
2H2O
| ||
2H2+O2
2H2O
;D与E反应:
| ||
Ca(OH)2+H2SO4=CaSO4+2H2O(或KOH与稀硫酸的反应)
Ca(OH)2+H2SO4=CaSO4+2H2O(或KOH与稀硫酸的反应)
.