摘要:42.现有一含杂质的固体氯化钡(BaCl2)样品.取12.5 g样品放入烧杯中.然后加入39.6 g水使其充分溶解.静置后滤去杂质.取10 g滤液.加入100 g硝酸银溶液.恰好完全反应生成白色沉淀.过滤后得到107.13 g的溶液.试计算:(1)生成白色沉淀多少克?(2)10 g滤液中溶质的质量分数.(3)样品中氯化钡的质量分数.
网址:http://m.1010jiajiao.com/timu_id_900805[举报]
现有一含杂质的固体氯化钡(BaCl2)样品(杂质不溶于水),取12.5g样品放入烧杯中,然后加入39.6g水使其充分溶解,静置后滤去杂质。取10g溶液,加入100g硝酸银溶液,恰好完全反应生成白色沉淀,过滤后得到107.13g溶液。试计算(计算结果精确到0.1%)
(1)生成白色沉淀多少克?
(2)10g溶液中溶质的质量分数?
(3)样品中氯化钡的质量分数。
查看习题详情和答案>>(2007?兰州)现有一含杂质的固体氯化钡(BaCl2)样品(杂质不溶于水),取12.5克样品放入烧杯中,然后加入39.6克水使其充分溶解,静置后滤去杂质.取10克滤液,加入100克硝酸银溶液,恰好完全反应生成白色沉淀,过滤后得到107.13克的溶液,试计算:(计算结果精确到0.1%)
(1)生成白色沉淀多少克?
(2)10克滤液中溶质的质量分数;
(3)样品中氯化钡的质量分数.
查看习题详情和答案>>
(1)生成白色沉淀多少克?
(2)10克滤液中溶质的质量分数;
(3)样品中氯化钡的质量分数.
(2013?槐荫区二模)现有某不纯的碳酸钠固体样品,已知其中含有的杂质可能是Na2SO4、CuSO4、NaCl、CaCl2中的一种或几种.为确定其杂质的成分,进行如下实验,出现的现象如图所示(设过程中所有发生的反应都恰好完全进行).
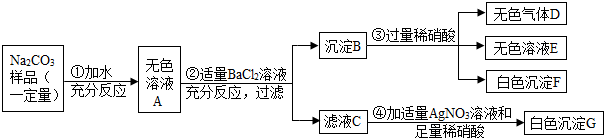
请你根据实验过程和发生的现象做出分析判断,并填写以下空白:
(1)把气体D通入紫色石蕊试液中,观察到的现象是
(2)碳酸钠固体样品中一定含有的杂质是(写化学式)
(3)碳酸钠固体样品中一定不含有的杂质是(写化学式)
(4)请写出过程②中发生反应的一个化学方程式
(5)碳酸钠固体样品中还不能确定的物质是(写化学式)
查看习题详情和答案>>

请你根据实验过程和发生的现象做出分析判断,并填写以下空白:
(1)把气体D通入紫色石蕊试液中,观察到的现象是
石蕊试液变红
石蕊试液变红
.白色沉淀G的化学式是AgCl
AgCl
.(2)碳酸钠固体样品中一定含有的杂质是(写化学式)
Na2CO3
Na2CO3
.(3)碳酸钠固体样品中一定不含有的杂质是(写化学式)
CuSO4
CuSO4
.(4)请写出过程②中发生反应的一个化学方程式
BaCl2+Na2CO3=BaCO3↓+2NaCl
BaCl2+Na2CO3=BaCO3↓+2NaCl
.(5)碳酸钠固体样品中还不能确定的物质是(写化学式)
NaCl
NaCl
,要确定它是否存在,可用溶液A再实验.请简述你的设计方案(说明实验操作步骤、发生的现象及结论):在A溶液中加入适量硝酸钡溶液,然后过滤,向滤液中加入适量硝酸银溶液和稀硝酸,若有白色沉淀,则说明含有氯化钠
在A溶液中加入适量硝酸钡溶液,然后过滤,向滤液中加入适量硝酸银溶液和稀硝酸,若有白色沉淀,则说明含有氯化钠
.某化学研究性学习小组欲测定实验室里一瓶久置的NaOH固体是否变质.请你和该小组的同学一起完成如下实验探究:
【作出猜想】猜想I:没变质,全部是NaOH;
猜想II:________
猜想Ⅲ:完全变质,全部是Na2CO3.
【查阅资料】①已知反应:BaCl2+Na2CO3=2NaCl+BaCO3↓
②部分盐溶液在常温下的pH如下:
| 盐溶液 | NaCI | Na2CO3 | BaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述氢氧化钠固体样品10.0g溶于50ml水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应后,静置. | ________ | 说明久置固体中,一定含有Na2CO3 |
| ②用玻璃棒蘸取少量①中充分反应后的上层清液滴在一小块pH试纸上,与标准比色卡对比,测出pH | pH=11 | 说明久置固体中,还一定含有________ |
【实验结论】通过实验,说明上述猜想中________是正确的.
【拓展】该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为3.94g,求原试剂中NaOH的质量分数.(写出计算过程,假定试剂中无其它杂质). 查看习题详情和答案>>
某化学研究性学习小组欲测定实验室里一瓶久置的NaOH固体是否变质.请你和该小组的同学一起完成如下实验探究:
【作出猜想】猜想I:没变质,全部是NaOH;
猜想II:______
猜想Ⅲ:完全变质,全部是Na2CO3.
【查阅资料】①已知反应:BaCl2+Na2CO3=2NaCl+BaCO3↓
②部分盐溶液在常温下的pH如下:
【设计方案并进行实验】请你与他们一起共同完成,并回答所给问题.
上述步骤①中,滴加过量BaCl2溶液的目的是______.
【实验结论】通过实验,说明上述猜想中______是正确的.
【拓展】该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为3.94g,求原试剂中NaOH的质量分数.(写出计算过程,假定试剂中无其它杂质).
查看习题详情和答案>>
【作出猜想】猜想I:没变质,全部是NaOH;
猜想II:______
猜想Ⅲ:完全变质,全部是Na2CO3.
【查阅资料】①已知反应:BaCl2+Na2CO3=2NaCl+BaCO3↓
②部分盐溶液在常温下的pH如下:
| 盐溶液 | NaCI | Na2CO3 | BaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述氢氧化钠固体样品10.0g溶于50ml水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应后,静置. | ______ | 说明久置固体中,一定含有Na2CO3 |
| ②用玻璃棒蘸取少量①中充分反应后的上层清液滴在一小块pH试纸上,与标准比色卡对比,测出pH | pH=11 | 说明久置固体中,还一定含有______ |
【实验结论】通过实验,说明上述猜想中______是正确的.
【拓展】该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为3.94g,求原试剂中NaOH的质量分数.(写出计算过程,假定试剂中无其它杂质).
查看习题详情和答案>>