网址:http://m.1010jiajiao.com/timu_id_897175[举报]
某同学探究酸碱中和反应是放热反应,他进行了下列实验操作:取稀硫酸30mL(密度为1.14 g/cm3),用温度计测出温度为13℃。然后向其中加人5.6 g NaOH固体,恰好完全反应。再用温度计测出温度为22℃。由此,该同学得出NaOH与稀硫酸发生的中和反应是放热反应的结论。请回答下列问题:
(1)该同学所得结论的依据是否科学? ___________ (选填“科学”或“不科学”)理由是_________________________________。
(2)根据本实验的目的,该实验需要控制的变量是______________________;请你改进他的实验操作____________________________________________。
(3)求算稀硫酸的溶质的质量分数。(精确到0.01)
查看习题详情和答案>>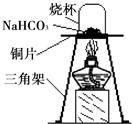 某化学兴趣小组的同学发现:发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致.发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.
某化学兴趣小组的同学发现:发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致.发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究.实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
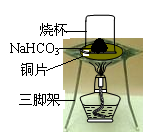
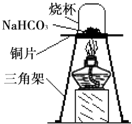
【进行实验】为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式:
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表:
| 实 验 操 作 | 预期实验现象 | 结 论 |
| 固体产物是Na2CO3,而不是NaOH. |
NaHCO3受热发生变化的化学方程式为
实验一:探究碳酸氢钠溶液的酸碱性用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈___________性。
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
【进行实验】为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如图所示。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊。写出该反应的化学方程式:_______________________________________________。
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3。
①他们猜想的依据是___________________________。
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表:

实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈______性.
实验二:探究碳酸氢钠的热稳定性
【查阅资料】碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质.
【进行实验】为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如图所示.
(1)加热一段时间后,观察到烧杯内壁有______.
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊.写出该反应的化学方程式:______.
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3.
①他们猜想的依据是______.
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表:
| 实 验 操 作 | 预期实验现象 | 结 论 |
| 固体产物是Na2CO3,而不是NaOH. |
NaHCO3受热发生变化的化学方程式为______.
某化学兴趣小组的同学发现:发酵粉能够使面团松软、发泡是因为发酵粉产生了CO2所致。发酵粉的主要成分中有碳酸氢钠(NaHCO3),俗称小苏打,他们对碳酸氢钠的性质进行了探究。
实验一:探究碳酸氢钠溶液的酸碱性
用pH试纸测得碳酸氢钠溶液的pH为10,由此可知碳酸氢钠溶液呈 性。
实验二:探究碳酸氢钠的热稳定性
《查阅资料》碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
《进行实验》为验证碳酸氢钠受热时会分解,兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如下图所示。

(1)加热一段时间后,观察到烧杯内壁有 。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的澄清石灰水,振荡,观察到石灰水变浑浊。写出该反应的化学方程式:______ _______________。
(3)兴趣小组的同学认为充分加热后的固体产物可能是NaOH或Na2CO3。
①他们猜想的依据是 ___________________________。
②请设计实验检验反应后的固体产物是NaOH还是Na2CO3,并填入下表:
| 实 验 操 作 | 预期实验现象 | 结 论 |
|
|
| 固体产物是Na2CO3,而不是NaOH。 |
《小结》
NaHCO3受热发生变化的化学方程式为 。
查看习题详情和答案>>