题目内容
某同学探究酸碱中和反应是放热反应,他进行了下列实验操作:取稀硫酸30mL(密度为1.14 g/cm3),用温度计测出温度为13℃。然后向其中加人5.6 g NaOH固体,恰好完全反应。再用温度计测出温度为22℃。由此,该同学得出NaOH与稀硫酸发生的中和反应是放热反应的结论。请回答下列问题:
(1)该同学所得结论的依据是否科学? ___________ (选填“科学”或“不科学”)理由是_________________________________。
(2)根据本实验的目的,该实验需要控制的变量是______________________;请你改进他的实验操作____________________________________________。
(3)求算稀硫酸的溶质的质量分数。(精确到0.01)
(1)不科学;NaOH固体溶于水时放出热量。
(2)两种反应物溶液的温度;先将5.6gNaOH固体溶于水配成溶液,并将其温度调节至13℃,然后与硫酸进行中和反应,反应结束后立即用温度计测盘溶液的温度。
(3)设所需H2SO4的质量为x
H2SO4+2NaOH==Na2SO4+2H2O
98 80
x 5.69
98:80=x:5.69
x= ![]() g
g
H2SO4的质量分数为
![]()
答:该稀硫酸的溶质的质量分数为20%。

练习册系列答案
相关题目
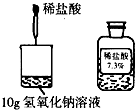
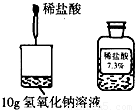
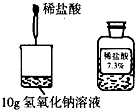 (2009?通州区二模)在探究酸碱中和反应时,某同学取10g氢氧化钠溶液滴入2滴酚酞试液后,将如图所示稀盐酸逐滴加入烧杯中,恰好完全反应时消耗稀盐酸的质量为5g.试计算:该氢氧化钠溶液(酚酞质量忽略不计)的质量分数是多少?
(2009?通州区二模)在探究酸碱中和反应时,某同学取10g氢氧化钠溶液滴入2滴酚酞试液后,将如图所示稀盐酸逐滴加入烧杯中,恰好完全反应时消耗稀盐酸的质量为5g.试计算:该氢氧化钠溶液(酚酞质量忽略不计)的质量分数是多少?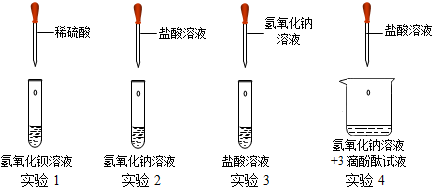
 在探究酸碱中和反应时,某同学取10g氢氧化钠溶液滴入2滴酚酞试液后,将如图所示稀盐酸逐滴加入烧杯中,恰好完全反应时消耗稀盐酸的质量为5g.试计算:该氢氧化钠溶液(酚酞质量忽略不计)的质量分数是多少?
在探究酸碱中和反应时,某同学取10g氢氧化钠溶液滴入2滴酚酞试液后,将如图所示稀盐酸逐滴加入烧杯中,恰好完全反应时消耗稀盐酸的质量为5g.试计算:该氢氧化钠溶液(酚酞质量忽略不计)的质量分数是多少?