摘要:22.作为空气质量观察员.你打算设计怎样的实验方案证明你的假设?答: 五.本大题只有1小题.6分.
网址:http://m.1010jiajiao.com/timu_id_896034[举报]
|
【查阅资料】:①白磷和红磷组成元素相同。白磷燃烧所需的
最低温度是40℃,而红磷需要240℃。
②紫色石蕊溶液是一种酸碱指示剂,酸性物质的溶液能使紫
色石蕊溶液变红。
【实验步骤】:
① 如右图所示连接仪器,检查装置的气密性良好。
② 在集气瓶里装入适量a体积的水,燃烧匙里放一块白磷,
在酒精灯上把玻璃棒下端加热后,立刻将集气瓶上的三孔胶塞塞紧。
③ 迅速将预热过的玻璃棒按下与白磷接触。观察到白磷燃烧,产生大量白烟。
④ 待白磷燃烧完毕,将集气瓶稍加振荡,白烟消失。
⑤ 待集气瓶完全冷却至室温,打开止水夹,量出集气瓶中水的体积为b,整个集气瓶的体积为c。
⑥ 根据a、b、c三个数据,计算出空气中氧气的体积分数。
根据以上实验信息,回答下列有关问题:
(1)为了充分 消耗容器中的氧气,药品中白磷的用量应保证 。
消耗容器中的氧气,药品中白磷的用量应保证 。
(2)若实验非常成功,请写出a、b、c三个数据应满足的一个等式关系 。
(3)小组成员小张对“实验前向集气瓶内装入适量a体积的水”不理解。咨询组长小明后,他终于明白加入水的作用,其一是 ;其二是 。
(4)小组成员小红无意间发现,向b体积水中滴加几滴紫色石蕊溶液,溶液会变成红色。请你对“变红”现象的原因提出大胆地猜想 。
查看习题详情和答案>>
我们知道氧气是人体生命所必需的,在一般情况下,人可以呼吸空气中的氧气,但在特殊情况下,如在核潜艇里工作的人员,如何获得氧气呢?研究表明用“金属过氧化物处理系统”使氧“再生”具有良好的实际应用价值.
已知:淡黄色的过氧化钠固体在常温下即能与二氧化碳反应生成氧气
反应方程式为:2Na2O2+2CO2═2Na2CO3+O2
(1)你认为用这种方法制氧气的优点是 ;
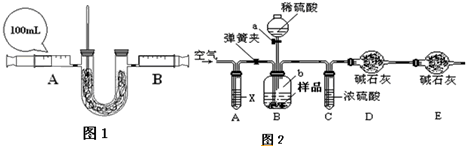
(2)小明欲探究过氧化钠吸收和释放的气体之间体积关系以及反应的热效应,设计实验如下,请回答下列相关问题:
①简述检查装置气密性的方法 ;
②向U形管内盛装过量的Na2O2药品,注射器中为二氧化碳气体,连接好装置.药品为什么需过量 ;
③缓缓推动注射器A活塞,片刻,可以观察到温度计液柱明显上升,说明反应 (填“吸热”或“放热”)同时还可以观察到固体粉末发生变化的现象是 ;
④小明查阅资料得知:相同的条件下,相同体积的气体具有相等的分子数,则待A注射器中二氧化碳气体反应完全后,装置恢复至常温,B注射器中活塞应停留在 mL处.(不考虑实验带来的误差)
(3)Na2O2露置在空气中容易发生变质,如何检验已经变质,简述方法、现象和结论.
变质的程度如何呢?部分同学对“已部分变质的Na2O2(含Na2CO3)的纯度测定”设计了实验,步骤如下:
①按图(1)连接装置,并检查气密性;②准确称得盛有碱石灰的干燥管D的质量为w1g;③准确称得mg样品放入容器b中;④打开a,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为w2g;⑥根据D装置质量差进行计算.试回答:
i写出盛放稀硫酸的实验仪器名称 ;
ii若④⑤两步的实验操作太快,则会导致测定的Na2O2的纯度 (填“偏大”或“偏小”).
iii鼓入空气的目的是 ,装置A中试剂X应选用 ;
ivE装置的作用是 ;
(4)小红同学通过查阅资料了解到Na2O2还能与水反应,方程式为:2Na2O2+2H2O═4NaOH+O2↑于是她根据这一原理设计了另一种测定Na2O2的纯度的方法:①称取20g样品于一只质量为45g的锥形中;②一次性加入20mL蒸馏水后将锥形瓶放置在电子天平上,观察显示数字的变化,并记录(数据见下表);③进行计算.
i从上表数据判断, 秒时,已经反应完全;
ii请你帮小红同学计算此样品中Na2O2的纯度,并写出过程.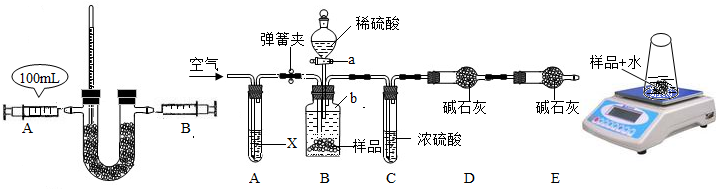 查看习题详情和答案>>
查看习题详情和答案>>
已知:淡黄色的过氧化钠固体在常温下即能与二氧化碳反应生成氧气
反应方程式为:2Na2O2+2CO2═2Na2CO3+O2
(1)你认为用这种方法制氧气的优点是
(2)小明欲探究过氧化钠吸收和释放的气体之间体积关系以及反应的热效应,设计实验如下,请回答下列相关问题:
①简述检查装置气密性的方法
②向U形管内盛装过量的Na2O2药品,注射器中为二氧化碳气体,连接好装置.药品为什么需过量
③缓缓推动注射器A活塞,片刻,可以观察到温度计液柱明显上升,说明反应
④小明查阅资料得知:相同的条件下,相同体积的气体具有相等的分子数,则待A注射器中二氧化碳气体反应完全后,装置恢复至常温,B注射器中活塞应停留在
(3)Na2O2露置在空气中容易发生变质,如何检验已经变质,简述方法、现象和结论.
变质的程度如何呢?部分同学对“已部分变质的Na2O2(含Na2CO3)的纯度测定”设计了实验,步骤如下:
①按图(1)连接装置,并检查气密性;②准确称得盛有碱石灰的干燥管D的质量为w1g;③准确称得mg样品放入容器b中;④打开a,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为w2g;⑥根据D装置质量差进行计算.试回答:
i写出盛放稀硫酸的实验仪器名称
ii若④⑤两步的实验操作太快,则会导致测定的Na2O2的纯度
iii鼓入空气的目的是
ivE装置的作用是
(4)小红同学通过查阅资料了解到Na2O2还能与水反应,方程式为:2Na2O2+2H2O═4NaOH+O2↑于是她根据这一原理设计了另一种测定Na2O2的纯度的方法:①称取20g样品于一只质量为45g的锥形中;②一次性加入20mL蒸馏水后将锥形瓶放置在电子天平上,观察显示数字的变化,并记录(数据见下表);③进行计算.
| 时间/s | 60 | 120 | 180 | 240 | 300 |
| 天平示数/g | 83.82 | 82.43 | 82.15 | 81.80 | 81.80 |
ii请你帮小红同学计算此样品中Na2O2的纯度,并写出过程.
 查看习题详情和答案>>
查看习题详情和答案>>
我们知道氧气是人体生命所必需的,在一般情况下,人可以呼吸空气中的氧气,但在特殊情况下,如在核潜艇里工作的人员,如何获得氧气呢?研究表明用“金属过氧化物处理系统”使氧“再生”具有良好的实际应用价值.
已知:淡黄色的过氧化钠固体在常温下即能与二氧化碳反应生成氧气反应方程式为:2Na2O2+2CO2═2Na2CO3+O2
(1)你认为用这种方法制氧气的优点是
(2)小明欲探究过氧化钠吸收和释放的气体之间体积关系以及反应的热效应,设计实验如图1,请回答下列相关问题:
①检查装置气密性.
②向U形管内盛装过量的Na2O2药品,注射器中为二氧化碳气体,连接好装置.
③缓缓推动注射器A活塞,片刻,可以观察到温度计液柱明显上升,说明反应放热,同时还可以观察到固体粉末发生变化的现象是
④小明查阅资料得知:相同的条件下,相同体积的气体具有相等的分子数,则待A注射器中二氧化碳气体反应完全后,装置恢复至常温,B注射器中活塞应停留在
(3)Na2O2露置在空气中容易发生变质,如何检验已经变质?简述方法、现象和结论.
变质的程度如何呢?部分同学对“已部分变质的Na2O2(含Na2CO3)的纯度测定”设计了实验,已知Na2O2与稀硫酸不反应,碱石灰能吸收CO2和H2O,步骤如下:
①按图2连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为w1g;
③准确称得mg样品放入容器b中;
④打开a,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为w2g;
⑥根据D装置质量差进行计算.
试回答:
(i)若④⑤两步的实验操作太快,则会导致测定的Na2O2的纯度
(填“偏大”或“偏小”).
(ii)鼓入空气的目的是
(iii)E装置的作用是
查看习题详情和答案>>

已知:淡黄色的过氧化钠固体在常温下即能与二氧化碳反应生成氧气反应方程式为:2Na2O2+2CO2═2Na2CO3+O2
(1)你认为用这种方法制氧气的优点是
反应条件低、方便携带、产物无污染、产生氧气同时还吸收了二氧化碳
反应条件低、方便携带、产物无污染、产生氧气同时还吸收了二氧化碳
.(2)小明欲探究过氧化钠吸收和释放的气体之间体积关系以及反应的热效应,设计实验如图1,请回答下列相关问题:
①检查装置气密性.
②向U形管内盛装过量的Na2O2药品,注射器中为二氧化碳气体,连接好装置.
③缓缓推动注射器A活塞,片刻,可以观察到温度计液柱明显上升,说明反应放热,同时还可以观察到固体粉末发生变化的现象是
淡黄色的粉末逐渐变为白色粉末
淡黄色的粉末逐渐变为白色粉末
;④小明查阅资料得知:相同的条件下,相同体积的气体具有相等的分子数,则待A注射器中二氧化碳气体反应完全后,装置恢复至常温,B注射器中活塞应停留在
50
50
mL处.(不考虑实验带来的误差)(3)Na2O2露置在空气中容易发生变质,如何检验已经变质?简述方法、现象和结论.
取少量固体样品滴加稀盐酸,将产生的气体通入澄清石灰水若出现浑浊说明已变质
取少量固体样品滴加稀盐酸,将产生的气体通入澄清石灰水若出现浑浊说明已变质
.变质的程度如何呢?部分同学对“已部分变质的Na2O2(含Na2CO3)的纯度测定”设计了实验,已知Na2O2与稀硫酸不反应,碱石灰能吸收CO2和H2O,步骤如下:
①按图2连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为w1g;
③准确称得mg样品放入容器b中;
④打开a,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为w2g;
⑥根据D装置质量差进行计算.
试回答:
(i)若④⑤两步的实验操作太快,则会导致测定的Na2O2的纯度
偏大
偏大
(填“偏大”或“偏小”).
(ii)鼓入空气的目的是
将装置中残留的二氧化碳鼓出,使反应充分
将装置中残留的二氧化碳鼓出,使反应充分
,装置A中试剂X应选用NaOH溶液
NaOH溶液
;(iii)E装置的作用是
防止空气中的二氧化碳和水蒸气进入D装置
防止空气中的二氧化碳和水蒸气进入D装置
.我们知道氧气是人体生命所必需的,在一般情况下,人可以呼吸空气中的氧气,但在特殊情况下,如在核潜艇里工作的人员,如何获得氧气呢?研究表明用“金属过氧化物处理系统”使氧“再生”具有良好的实际应用价值.
已知:淡黄色的过氧化钠固体在常温下即能与二氧化碳反应生成氧气
反应方程式为:2Na2O2+2CO2═2Na2CO3+O2
(1)你认为用这种方法制氧气的优点是______;
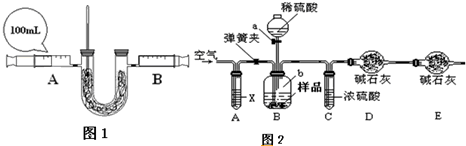
(2)小明欲探究过氧化钠吸收和释放的气体之间体积关系以及反应的热效应,设计实验如下,请回答下列相关问题:
①简述检查装置气密性的方法______;
②向U形管内盛装过量的Na2O2药品,注射器中为二氧化碳气体,连接好装置.药品为什么需过量______;
③缓缓推动注射器A活塞,片刻,可以观察到温度计液柱明显上升,说明反应______(填“吸热”或“放热”)同时还可以观察到固体粉末发生变化的现象是______;
④小明查阅资料得知:相同的条件下,相同体积的气体具有相等的分子数,则待A注射器中二氧化碳气体反应完全后,装置恢复至常温,B注射器中活塞应停留在______mL处.(不考虑实验带来的误差)
(3)Na2O2露置在空气中容易发生变质,如何检验已经变质,简述方法、现象和结论.______
变质的程度如何呢?部分同学对“已部分变质的Na2O2(含Na2CO3)的纯度测定”设计了实验,步骤如下:
①按图(1)连接装置,并检查气密性;②准确称得盛有碱石灰的干燥管D的质量为w1g;③准确称得mg样品放入容器b中;④打开a,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为w2g;⑥根据D装置质量差进行计算.试回答:
i写出盛放稀硫酸的实验仪器名称______;
ii若④⑤两步的实验操作太快,则会导致测定的Na2O2的纯度______(填“偏大”或“偏小”).
iii鼓入空气的目的是______,装置A中试剂X应选用______;
ivE装置的作用是______;
(4)小红同学通过查阅资料了解到Na2O2还能与水反应,方程式为:2Na2O2+2H2O═4NaOH+O2↑于是她根据这一原理设计了另一种测定Na2O2的纯度的方法:①称取20g样品于一只质量为45g的锥形中;②一次性加入20mL蒸馏水后将锥形瓶放置在电子天平上,观察显示数字的变化,并记录(数据见下表);③进行计算.
| 时间/s | 60 | 120 | 180 | 240 | 300 |
| 天平示数/g | 83.82 | 82.43 | 82.15 | 81.80 | 81.80 |
ii请你帮小红同学计算此样品中Na2O2的纯度,并写出过程.
 查看习题详情和答案>>
查看习题详情和答案>>