网址:http://m.1010jiajiao.com/timu_id_890832[举报]
根据侯德榜制碱法原理,实验室制备纯碱(Na2CO3)的主要步骤是::将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,经过处理后,转入蒸发皿中,灼烧2小时,得Na2CO3固体。
四种盐在不同温度下的溶解度(g)表
|
溶解度 盐 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
① |
—— |
—— |
—— |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
—— |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
 已知:1、①温度高于35℃NH4HCO3会分解。
已知:1、①温度高于35℃NH4HCO3会分解。
2、碳酸氢钠受热分解:2 NaHCO3= Na2CO3+H2O+CO2↑
(1)饱和NaCl溶液中加入NH4HCO3固体,发生了复分解反应,生成NaHCO3晶体,写出其中发生反应的化学方程式 。
(2)加料完毕后,继续保温30分钟,目的是 ,用蒸馏水洗涤NaHCO3晶体的目的是除去杂质,杂质中一定含有的物质是 (以化学式表示)。
(3)过滤掉NaHCO3晶体后的滤液中还有一定量的NaHCO3溶解在水中,此时可向滤液中加入一定量的 ,并作进一步处理,使NaCl溶液循环使用。
(4)某小苏打样品中混有少量碳酸钠,取药品2.0g加热到质量不再减少为止,共收集到二氧化碳气体0.22L(二氧化碳的密度为2.0g/L)。向加热后的剩余固体中加入一定量质量分数为3.65%的稀盐酸,使其恰好完全反应,求消耗该稀盐酸的质量是多少克?
查看习题详情和答案>>
四种盐在不同温度下的溶解度(g)表
温度 溶解度 盐 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | ① | -- | -- | -- |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | -- |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
1、①温度高于35℃NH4HCO3会分解.
2、碳酸氢钠受热分解:2NaHCO3
| ||
(1)饱和NaCl溶液中加入NH4HCO3固体,发生了复分解反应,生成NaHCO3晶体,写出其中发生反应的化学方程式
(2)加料完毕后,继续保温30分钟,目的是
(3)过滤掉NaHCO3晶体后的滤液中还有一定量的NaHCO3溶解在水中,此时可向滤液中加入一定量的
(4)某小苏打样品中混有少量碳酸钠,取药品2.0g加热到质量不再减少为止,共收集到二氧化碳气体0.22L(二氧化碳的密度为2.0g/L).向加热后的剩余固体中加入一定量质量分数为3.65%的稀盐酸,使其恰好完全反应,求消耗该稀盐酸的质量是多少克?
 (2012?鼓楼区一模)研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.
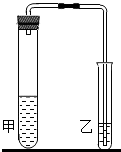
(2012?鼓楼区一模)研究性学习小组对碳酸钠和碳酸氢钠的性质进行探究,请你参与实验.(1)我们在学习碳酸钠和碳酸氢钠的时候,做过如如图装置的实验.向盛有0.5g碳酸钠的试管里加入2mL盐酸,迅速用带导管的胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中,观察现象.用碳酸氢钠代替碳酸钠进行上述实验,观察现象.
通过比较试管甲中的两次反应,填写下表:
| 碳酸钠+盐酸 | 碳酸氢钠+盐酸 | |
| 实验现象 | ||
| 化学反应方程式 |
(2)以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体.
四种盐在不同温度下的溶解度表:(g/100g水)
温度 溶解度 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | - | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
②过滤所得母液中含有NaHCO3、NaCl、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使
(3)分别取碳酸氢钠4.2g和碳酸钠5.3g放入相同大小的锥形瓶中,分别在密闭条件下加入相同质量、相同浓度的盐酸(足量).在相同的条件下,测量出生成气体的体积,得到时间-体积关系曲线图应为
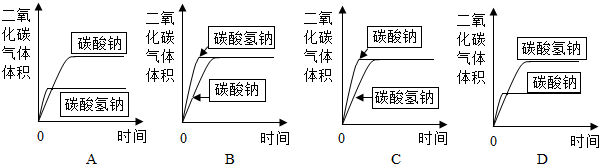
通过分析和计算说明你的理由.
(7分)水在日常生活、工农业生产、科学研究领域有着重要及广泛的用途。
(1)从化学视角看水。从组成角度看,电解水实验证明了水由____组成;从微粒角度看,水由____(填“分子”、“原子”或“离子”)构成。
(2)水能参加许多化学反应。右图是一种家用环保型消毒液发生器:原理是电解饱和氯化钠溶液,制得的消毒液有较强的杀菌能力,该反应是利用氯化钠和水在通电条件下生成氢氧化钠、氢气和氯气,该反应的化学方程式为____;从能量变化角度看,该反应中____转化为化学能。
(3)水是一种重要的溶剂。下表表示的是不同温度下4种盐在水中的溶解度。
| | 10℃ | 20℃ | 30℃ |
| NaCI | 35.8 | 36.0 | 36.3 |
| NH4HCO3 | 15.8 | 21.0 | 27.O |
| NaHCO3 | 8.1 | 9.6 | 11.1 |
| NH4Cl | 33.3 | 37.2 | 41.4 |
①上述4种盐中,30℃时溶解度最大的是____。
②10℃时将16.8gNH4HCO3固体放入100g水中充分溶解,所得溶液为____ (填“饱和”或“不饱和”)溶液。
③在20℃时,向含NH4HCO3 21 g的饱和溶液中加入足量食盐。随着食盐的加入,能析出的晶体是____。
A.NH4HCO3 B. NH4Cl C.NaHCO3 查看习题详情和答案>>
(1)从化学视角看水。从组成角度看,电解水实验证明了水由____组成;从微粒角度看,水由____(填“分子”、“原子”或“离子”)构成。
(2)水能参加许多化学反应。右图是一种家用环保型消毒液发生器:原理是电解饱和氯化钠溶液,制得的消毒液有较强的杀菌能力,该反应是利用氯化钠和水在通电条件下生成氢氧化钠、氢气和氯气,该反应的化学方程式为____;从能量变化角度看,该反应中____转化为化学能。

(3)水是一种重要的溶剂。下表表示的是不同温度下4种盐在水中的溶解度。
| | 10℃ | 20℃ | 30℃ |
| NaCI | 35.8 | 36.0 | 36.3 |
| NH4HCO3 | 15.8 | 21.0 | 27.O |
| NaHCO3 | 8.1 | 9.6 | 11.1 |
| NH4Cl | 33.3 | 37.2 | 41.4 |
①上述4种盐中,30℃时溶解度最大的是____。
②10℃时将16.8gNH4HCO3固体放入100g水中充分溶解,所得溶液为____ (填“饱和”或“不饱和”)溶液。
③在20℃时,向含NH4HCO3 21 g的饱和溶液中加入足量食盐。随着食盐的加入,能析出的晶体是____。
A.NH4HCO3 B. NH4Cl C.NaHCO3
 温度
温度