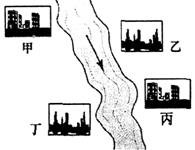
摘要:(3)在河旁有甲.乙.丙.丁四座工厂.每个工厂排出的废液只含有...中的一种.某环保小组对河水监测时发现:甲处河水呈无色,乙处河水呈红褐色,丙处河水由浑变清,丁处产生气泡.河水澄清.请回答:
网址:http://m.1010jiajiao.com/timu_id_889047[举报]
水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用.
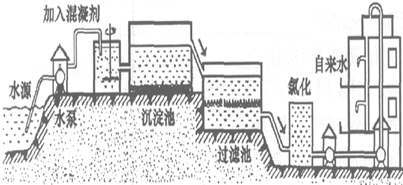
(1)自来水的生产过程大体如图:
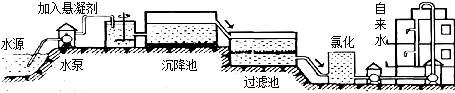
上图过滤池中有活性炭层,活性炭起______作用,该过程中发生______变化.氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸.实验室配制AgNO3溶液时不宜使用自来水,其原因是(用化学方程式表示)______.
(2)电解水时,加入少量NaOH可以增强水的导电性.现将0.1gNaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是______,当溶液中NaOH的质量分数变为0.2%时,有______水被分解.
 (3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
(3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是______.
②乙处河水呈红褐色的化学方程式是______.
③丁处产生气泡的化学方程式是______.
查看习题详情和答案>>
水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用.
(1)自来水的生产过程大体如图:

上图过滤池中有活性炭层,活性炭起______作用,该过程中发生______变化.氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸.实验室配制AgNO3溶液时不宜使用自来水,其原因是(用化学方程式表示)______.
(2)电解水时,加入少量NaOH可以增强水的导电性.现将0.1gNaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是______,当溶液中NaOH的质量分数变为0.2%时,有______水被分解.
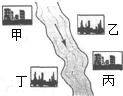
 (3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
(3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是______.
②乙处河水呈红褐色的化学方程式是______.
③丁处产生气泡的化学方程式是______.
查看习题详情和答案>>
(1)自来水的生产过程大体如图:

上图过滤池中有活性炭层,活性炭起______作用,该过程中发生______变化.氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸.实验室配制AgNO3溶液时不宜使用自来水,其原因是(用化学方程式表示)______.
(2)电解水时,加入少量NaOH可以增强水的导电性.现将0.1gNaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是______,当溶液中NaOH的质量分数变为0.2%时,有______水被分解.
 (3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
(3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是______.
②乙处河水呈红褐色的化学方程式是______.
③丁处产生气泡的化学方程式是______.
查看习题详情和答案>>
28、水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用.
(1)自来水的生产过程大体如图:
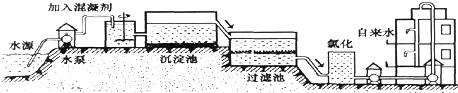
上图过滤池中有活性炭层,活性炭起
(2)电解水时,加入少量NaOH可以增强水的导电性.现将0.1gNaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是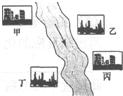
(3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是
②乙处河水呈红褐色的化学方程式是
③丁处产生气泡的化学方程式是
查看习题详情和答案>>
(1)自来水的生产过程大体如图:

上图过滤池中有活性炭层,活性炭起
吸附
作用,该过程中发生物理
变化.氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸.实验室配制AgNO3溶液时不宜使用自来水,其原因是(用化学方程式表示)AgNO3+HCl═AgCl↓+HNO3
.(2)电解水时,加入少量NaOH可以增强水的导电性.现将0.1gNaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是
O2
,当溶液中NaOH的质量分数变为0.2%时,有50g
水被分解.
(3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是
酚酞试液
.②乙处河水呈红褐色的化学方程式是
FeCl3+3NaOH═Fe(OH)3↓+3NaCl
.③丁处产生气泡的化学方程式是
Na2CO3+2HCl═2NaCl+H2O+CO2↑
.水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用.
(1)自来水的生产过程大体如下图:
如图过滤池中有活性炭,活性炭起______作用,该过程发生的______变化.氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸,其反应化学方程式为______.实验室配置AgNO3溶液时不宜用自来水,其原因是(用化学方程式表示)______.高铁酸钾(K2FeO4)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是______.
(2)如图,在河旁有甲、乙、丙、丁四座工厂,每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种.某环保小组对河水监测时发现:甲处河水呈无色;乙处河水中有红褐色物质生成;丙处河水由浑变清;丁处产生气泡,河水澄清.请回答:
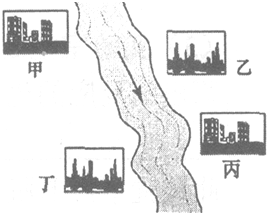
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是______.
②乙处河水有红褐色物质生成的化学方程式是______.
③丁处产生气泡的化学方程式是______.
(3)保护水资源,我们应该采取的措施是______.
查看习题详情和答案>>
水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。
(1)自来水的生产过程大体如下图:
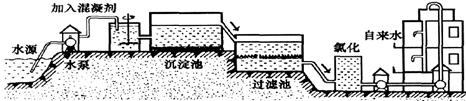
上图过滤池中有活性炭,活性炭起_______作用,该过程发生的_______变化。氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸,其反应化学方程式为___________________。实验室配置AgNO3溶液时不宜用自来水,其原因是(用化学方程式表示)_______________。高铁酸钾(K2FeO4)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是________。
(2)如图,在河旁有甲、乙、丙、丁四座工厂,每个工厂排出的废液只含有Na2CO3、FeCl3、NaOH、HCl中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水中有红褐色物质生成;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是_________。
②乙处河水有红褐色物质生成的化学方程式是___________________________。
③丁处产生气泡的化学方程式是____________________________________。
(3)保护水资源,我们应该采取的措施是___________________________。