摘要:(1)上述方法中可以得到干燥.纯净的气体是 .(2)指出不能用上述方法得到的气体.并说明理由(可以不填满.也可以补充)①气体 .理由是 .②气体 .理由是 .
网址:http://m.1010jiajiao.com/timu_id_888527[举报]
(2012?历下区二模)下图为实验室常见的制备、干燥、性质实验的部分仪器,试根椐题目要求,回答下列问颢: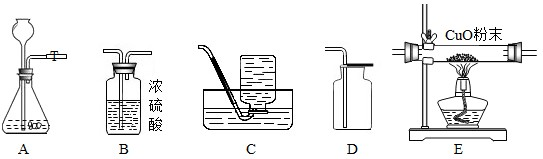
(1)若以过氧化氢溶液和二氧化锰为原料在实验室中制备并收集干燥的氧气.
①所选仪器的连接顺序为:
②制取氧气时,所发生反应的化学方程式为:
③检验A装置气密性的方法是:
(2)为探究氢气是否具有还原性,将上述部分仪器按A→B1→E→B2→B3 (B1、B2、B3为三个浓硫酸洗气瓶)的顺序连接.
①仪器B1的作用是
②若E中固体粉末由黑色变为红色,B2质量增加,则证明氢气具有还原性.试写出E中发生反应的化学方程式
③实验完毕后,B2装置质量增加了0.9g,则E装置中固体质量减少
④实验室用锌与硫酸反应制取氢气后的剩余废液中,常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从适量BaCl2溶液、适量Zn粉、适量NaOH溶液三种试剂中选用一种试剂除杂并简述回收硫酸锌晶体的实验过程:
查看习题详情和答案>>

(1)若以过氧化氢溶液和二氧化锰为原料在实验室中制备并收集干燥的氧气.
①所选仪器的连接顺序为:
A→B→D
A→B→D
(填写仪器序号字母).②制取氧气时,所发生反应的化学方程式为:
2H2O2
2H2O+O2↑.
| ||
2H2O2
2H2O+O2↑.
.
| ||
③检验A装置气密性的方法是:
先从长颈漏斗中注入水,当水浸没其下端管口时,用弹簧夹夹住导气管上连接的胶皮管,然后再加入少量的水,若停止加水后,长颈漏斗中的水面不再下降,则说明此装置气密性良好
先从长颈漏斗中注入水,当水浸没其下端管口时,用弹簧夹夹住导气管上连接的胶皮管,然后再加入少量的水,若停止加水后,长颈漏斗中的水面不再下降,则说明此装置气密性良好
.(2)为探究氢气是否具有还原性,将上述部分仪器按A→B1→E→B2→B3 (B1、B2、B3为三个浓硫酸洗气瓶)的顺序连接.
①仪器B1的作用是
除去氢气中的水蒸气或干燥氢气
除去氢气中的水蒸气或干燥氢气
;②若E中固体粉末由黑色变为红色,B2质量增加,则证明氢气具有还原性.试写出E中发生反应的化学方程式
H2+CuO
Cu+H2O
| ||
H2+CuO
Cu+H2O
;
| ||
③实验完毕后,B2装置质量增加了0.9g,则E装置中固体质量减少
0.8
0.8
g.④实验室用锌与硫酸反应制取氢气后的剩余废液中,常含有少量剩余的硫酸,欲除去多余的硫酸并回收硫酸锌晶体,请从适量BaCl2溶液、适量Zn粉、适量NaOH溶液三种试剂中选用一种试剂除杂并简述回收硫酸锌晶体的实验过程:
向废液中加入足量的锌粉,充分反应后过滤,将滤液蒸发、冷却、结晶,即可得到较纯净的硫酸锌晶体
向废液中加入足量的锌粉,充分反应后过滤,将滤液蒸发、冷却、结晶,即可得到较纯净的硫酸锌晶体
.实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气.
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):
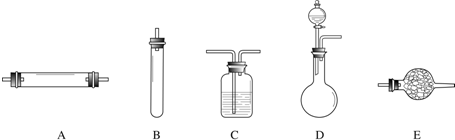
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置
(3)方法三:制氮气的化学方程式为:
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂.在制取氮气的3种方法中,联合使用方法一和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:
(5)1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
查看习题详情和答案>>
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气.
进行实验时可选择的实验仪器如下图所示(省略夹持装置与加热装置):

(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
D
D
(选填装置编号).请写出生石灰在此反应中的两个作用:生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度)
生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度)
,生石灰与水反应,减少了溶剂
生石灰与水反应,减少了溶剂
.(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置
E
E
(选填装置编号)中加入碱石灰
碱石灰
以除去其它杂质气体.(3)方法三:制氮气的化学方程式为:
NaNO2+NH4Cl
NaCl+N2↑+2H2O
| ||
NaNO2+NH4Cl
NaCl+N2↑+2H2O
.
| ||
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂.在制取氮气的3种方法中,联合使用方法一和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:
铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染)
铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染)
.(5)1892年,英国科学家瑞利(Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大5‰左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
方法二制得的氮气中含有密度(或相对分子质量)比氮气大的稀有气体,导致密度偏大
方法二制得的氮气中含有密度(或相对分子质量)比氮气大的稀有气体,导致密度偏大
.(2013?平江区二模)实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气,产物中还含有相对分子量最小的氧化物.进行实验时可选择的实验仪器如图所示(省略夹持装置与加热装置):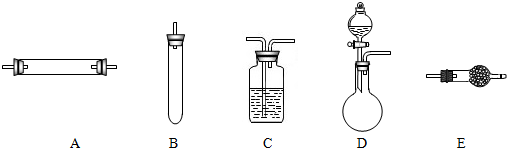
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_
(3)方法三:制氮气的化学方程式为
(4)1892年,英国科学家瑞利(( Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大50‰.左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
查看习题详情和答案>>
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气,产物中还含有相对分子量最小的氧化物.进行实验时可选择的实验仪器如图所示(省略夹持装置与加热装置):

(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最好选用
D
D
(选填装置编号).请写出生石灰在此反应中的作用:生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度);生石灰与水反应,减少了溶剂
生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度);生石灰与水反应,减少了溶剂
(2)方法二:为保证所得氮气尽可能纯净,除了使用铜外,还可以向装置_
E
E
(选填装置编号)中加入碱石灰
碱石灰
以除去其它杂质气体.(3)方法三:制氮气的化学方程式为
NaNO2+NH4Cl
NaCl+N2↑+2H2O
| ||
NaNO2+NH4Cl
NaCl+N2↑+2H2O
.
| ||
(4)1892年,英国科学家瑞利(( Rayleigh)发现,采用方法二得到的氮气在相同条件下比方法三得到的氮气密度总是偏大50‰.左右.若上述实验设计与操作均无错误,且氮气已完全干燥,请解释产生这一现象的原因:
方法二制得的氮气中含有密度(或相对分子质量)比氮气大的稀有气体,导致密度偏大
方法二制得的氮气中含有密度(或相对分子质量)比氮气大的稀有气体,导致密度偏大
.双氧水(H2O2)不仅可以在美容业除去色斑,也可以在常温下以二氧化锰为催化剂制取氧气(2H2O2![]() 2H2O+O2↑).某同学设计了上图装置制取表中的三种干燥、纯净的气体.图中铁架台、铁夹及气体收集装置都已略去,A、B、C、D表示相应仪器中加入的试剂.
2H2O+O2↑).某同学设计了上图装置制取表中的三种干燥、纯净的气体.图中铁架台、铁夹及气体收集装置都已略去,A、B、C、D表示相应仪器中加入的试剂.
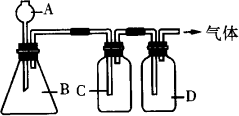

(1)上述方法中可以得到干燥、纯净的气体是________.
(2)指出不能用上述方法得到的气体,并说明理由(可以不填满,也可以补充).
①气体________,理由是________.
②气体________,理由是________.
双氧水(H2O2)不仅可以在美容业中除去色斑,也可以在常温下以二氧化锰为催化剂制取氧气(2H2O2![]() 2H2O+O2↑).某同学设计了下图装置制取表中的三种干燥、纯净的气体.图中铁架台、铁夹及气体收集装置都已略去,A、B、C、D表示相应仪器中加入的试剂.
2H2O+O2↑).某同学设计了下图装置制取表中的三种干燥、纯净的气体.图中铁架台、铁夹及气体收集装置都已略去,A、B、C、D表示相应仪器中加入的试剂.
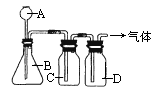

(1)上述方法中可以得到干燥、纯净的气体是________.
(2)指出不能用上述方法得到的气体,并说明理由(可以不填满,也可以补充):
①气体________,理由是________________________________.
②气体________,理由是________________________________.
查看习题详情和答案>>