摘要:4l.用化学方程式来证明下列结论是错误的:(1)置换反应一定生成氢气 . (2)有盐和水生成的反应一定是中和反应 .
网址:http://m.1010jiajiao.com/timu_id_888524[举报]
18、下列说法均是错误的,请各用一个化学方程式来证明它的错误:
(1)分解反应前后元素的化合价一定改变
(2)有盐和水生成的反应一定是中和反应
查看习题详情和答案>>
(1)分解反应前后元素的化合价一定改变
H2CO3═H2O+CO2↑
,(2)有盐和水生成的反应一定是中和反应
CO2+2NaOH=Na2CO3+H2O
.请仔细阅读下文,然后按要求写出有关反应的化学方程式:
食醋的主要成分是醋酸(化学式为CH3COOH ),其化学名称叫乙酸,是一种用途广泛的有机酸.通常情况下,纯净的乙酸是一种有强烈刺激性气味的无色液体,易溶于水和酒精.在水溶液中,乙酸只能解离出氢离子和乙酸根离子(CH3COO-);乙酸能跟活泼金属发生置换反应产生氢气,例如,跟锌反应的化学方程式可表示为:Zn+2CH3COOH═(CH3COO)2Zn+H2↑.
(1)请你写出醋酸分别跟氢氧化钠溶液、氧化铜反应的化学方程式;
(2)用化学方程式说明为什么家用的铝制器皿不宜用来盛放或烧煮食醋.
(3)铝是一种活泼金属,铝的化学性质较为特殊,它不但能跟盐酸反应生成三氯化铝和氢气,还能跟热的氢氧化钠水溶液起反应生成偏铝酸钠(NaAlO2)和氢气.请你写出该反应的化学方程式.
查看习题详情和答案>>
食醋的主要成分是醋酸(化学式为CH3COOH ),其化学名称叫乙酸,是一种用途广泛的有机酸.通常情况下,纯净的乙酸是一种有强烈刺激性气味的无色液体,易溶于水和酒精.在水溶液中,乙酸只能解离出氢离子和乙酸根离子(CH3COO-);乙酸能跟活泼金属发生置换反应产生氢气,例如,跟锌反应的化学方程式可表示为:Zn+2CH3COOH═(CH3COO)2Zn+H2↑.
(1)请你写出醋酸分别跟氢氧化钠溶液、氧化铜反应的化学方程式;
(2)用化学方程式说明为什么家用的铝制器皿不宜用来盛放或烧煮食醋.
(3)铝是一种活泼金属,铝的化学性质较为特殊,它不但能跟盐酸反应生成三氯化铝和氢气,还能跟热的氢氧化钠水溶液起反应生成偏铝酸钠(NaAlO2)和氢气.请你写出该反应的化学方程式.
金属材料、无机非金属材料、有机高分子材料是人类使用的三大类基础材料.
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于
(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产过程如下:
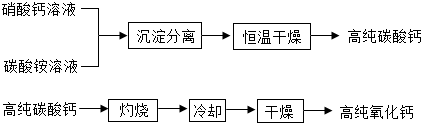
请回答下问题:
①硝酸钙与碳酸铵在溶液中反应的化学方程式为
②生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是
③高纯氧化钙生产过程中,“干燥”的主要目的是为了防止
(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫,该材料的使用可减少白色污染.尼龙因其抽成细丝而像蚕丝,生活中可采用
查看习题详情和答案>>
(1)金属材料中,有一类贮氢合金能够结合氢气形成金属化合物,并在一定条件下分解释放出氢气,该贮运原理属于
化学
化学
变化.钢铁是制造轮船的主要金属材料,船身外通常装上一定数目比铁更活泼的金属块以防止腐蚀,该金属块可以选择锌块
锌块
(填“铜块”“锌块”或“铅块”).(2)无机非金属材料中,用于电子工业的高纯碳酸钙、高纯氧化钙生产过程如下:

请回答下问题:
①硝酸钙与碳酸铵在溶液中反应的化学方程式为
(NH4)2CO3+Ca(NO3)2﹦CaCO3↓+2NH4 NO3
(NH4)2CO3+Ca(NO3)2﹦CaCO3↓+2NH4 NO3
.②生产高纯碳酸钙时,选择“220℃恒温干燥”而不选择“灼烧”的原因是
防止部分碳酸钙分解生成氧化钙
防止部分碳酸钙分解生成氧化钙
.③高纯氧化钙生产过程中,“干燥”的主要目的是为了防止
CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
(用化学方程式表示).(3)有机高分子材料“玉米塑料”,因其可降解被广泛用来替代一次性泡沫,该材料的使用可减少白色污染.尼龙因其抽成细丝而像蚕丝,生活中可采用
燃烧并闻气味
燃烧并闻气味
方法区分尼龙和蚕丝.29、酸碱盐知识在化学领域中有着广泛应用.
(1)治疗胃酸常使用氢氧化镁[Mg(OH)2],用化学方程式表示氢氧化镁治疗胃酸的原理
(2)实验室有一包白色固体A.A由下列四种物质中的三种混合而成:NaCl、K2SO4、Na2CO3、BaCl2.将A加足量水搅拌后,滤去白色不溶物,滤液中的溶质仅有NaCl.判断A的成分有
(3)某同学不小心将氯化钠与氢氧化钙固体混在了一起.他设计如下流程来提取纯净的固体食盐:
取少量固体→操作a→加过量的A溶液→操作b→加适量的B溶液→操作c→精制固体食盐
①操作a名称是
②A物质的名称
③B物质的化学式
④已知20℃时氯化钠的溶解度为36g.在此温度下,若将上述实验中得到的2g纯净固体食盐溶解在10g水中,所得溶液是
查看习题详情和答案>>
(1)治疗胃酸常使用氢氧化镁[Mg(OH)2],用化学方程式表示氢氧化镁治疗胃酸的原理
Mg(OH)2+2HCl═MgCl2+2H2O
.(2)实验室有一包白色固体A.A由下列四种物质中的三种混合而成:NaCl、K2SO4、Na2CO3、BaCl2.将A加足量水搅拌后,滤去白色不溶物,滤液中的溶质仅有NaCl.判断A的成分有
NaCl、Na2CO3和BaCl2
.(3)某同学不小心将氯化钠与氢氧化钙固体混在了一起.他设计如下流程来提取纯净的固体食盐:
取少量固体→操作a→加过量的A溶液→操作b→加适量的B溶液→操作c→精制固体食盐
①操作a名称是
溶解
;操作C用到的主要仪器有蒸发皿、酒精灯、玻璃棒和铁架台
.②A物质的名称
碳酸钠
.③B物质的化学式
HCl
;用化学方程式表示B的作用2HCl+Na2CO3═2NaCl+CO2↑+H2O
,NaOH+HCl=NaCl+H2O
.④已知20℃时氯化钠的溶解度为36g.在此温度下,若将上述实验中得到的2g纯净固体食盐溶解在10g水中,所得溶液是
不饱和溶液
(填“饱和溶液”或“不饱和溶液”).在一次探究实验中,小岳同学发现盛有NaOH溶液的试剂瓶的瓶口有白色粉末.为了弄清其成分,小岳请教了实验老师,老师只告诉他记得这瓶溶液是用自来水配制的(自来水因用Cl2消毒而会含有少量的HCl).小岳同学想了很久,猜想此白色粉末可能是由NaOH、Na2CO3、NaCl组成的.于是他设计了如下实验方案.请你帮助他完成实验报告并回答有关问题:
(1)完成实验报告:
(2)回答下列问题:
①在第Ⅱ步实验中,小岳向样品中加入稀盐酸后,为什么没有现象?请用化学方程式来表示原因:
②在第Ⅳ步实验中,为什么要加Ba(NO3)2溶液,而不是BaCl2溶液?
③在第Ⅴ步实验中,小岳同学加足量稀HNO3的目的是什么?
④实验结束后,小岳发现有些问题,你发现了吗?请回答:
查看习题详情和答案>>
(1)完成实验报告:
| 实验步骤 | 实验现象 | 实验结论 | |
Ⅰ |
用小刀刮一些白色粉末于试管中,加水溶解,分成A、B、C三份 | 无色溶液 |
此粉末中可能含有碳酸钠、氢氧化钠、氯化钠 此粉末中可能含有碳酸钠、氢氧化钠、氯化钠 |
| Ⅱ | 取Ⅰ中A溶液,向其中滴加几滴无色酚酞试液 | 变红 | 说明此粉末中有NaOH |
| 取Ⅰ中B溶液,向其中滴加几滴稀盐酸 | 无任何现象 | 说明此粉末中无Na2CO3 | |
| 取Ⅰ中C溶液,向其中滴加几滴BaCl2溶液,过滤 | 白色沉淀 | 此白色粉末中有Na2CO3 此白色粉末中有Na2CO3 | |
| Ⅲ | 取Ⅱ中白色沉淀,向其中滴加几滴稀盐酸 | 生成能使澄清石灰水变浑浊的气体 | 说明: 此白色粉末中有Na2CO3 此白色粉末中有Na2CO3 |
Ⅳ |
重新取样溶于水,向其中加入足量Ba(NO3)2溶液, | 白色沉淀 | 此白色粉末中有Na2CO3 此白色粉末中有Na2CO3 |
| 过滤,向滤液中加入几滴无色酚酞试液 | 变红 |
说明: 此白色粉末中有NaOH 此白色粉末中有NaOH | |
Ⅴ |
向Ⅳ过滤后所得的溶液中加入足量的稀HNO3,测溶液的PH | PH<7 | 溶液呈酸性 溶液呈酸性 |
| Ⅵ | 向Ⅴ实验后的溶液中加入几滴AgNO3溶液 | 白色沉淀 |
说明: 此白色粉末中有NaCl 此白色粉末中有NaCl |
①在第Ⅱ步实验中,小岳向样品中加入稀盐酸后,为什么没有现象?请用化学方程式来表示原因:
HCl+NaOH═NaCl+H2O
HCl+NaOH═NaCl+H2O
;②在第Ⅳ步实验中,为什么要加Ba(NO3)2溶液,而不是BaCl2溶液?
若加入BaCl2溶液,则会对NaCl鉴定形成干扰
若加入BaCl2溶液,则会对NaCl鉴定形成干扰
;③在第Ⅴ步实验中,小岳同学加足量稀HNO3的目的是什么?
检验下步生成的沉淀是不是AgCl
检验下步生成的沉淀是不是AgCl
;④实验结束后,小岳发现有些问题,你发现了吗?请回答:
在第Ⅱ步中对A溶液的实验结论有错误,酚酞试液变红并不能说明有NaOH,在第Ⅱ步中对B溶液的实验结论有错误,加盐酸没有现象是因为此粉末中有NaOH
在第Ⅱ步中对A溶液的实验结论有错误,酚酞试液变红并不能说明有NaOH,在第Ⅱ步中对B溶液的实验结论有错误,加盐酸没有现象是因为此粉末中有NaOH
.