摘要:(1)反应中产生的质量.(2)纯碱中碳酸钠的质量分数.
网址:http://m.1010jiajiao.com/timu_id_887932[举报]
碳酸钠用途非常广泛,是工业生产中重要的化工原料。在1921年我国科学家 侯德榜创造了一种著名的纯碱生产方法--“联合制碱法”。 “联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O=== NH4HCO3 该反应属于 反应(基本反应类型)。
第二步用食盐与NH4HCO3反应。食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁。经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下:
(1)第一步主要反应为NH3+CO2+H2O=== NH4HCO3 该反应属于 反应(基本反应类型)。
第二步用食盐与NH4HCO3反应。食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁。经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如下:
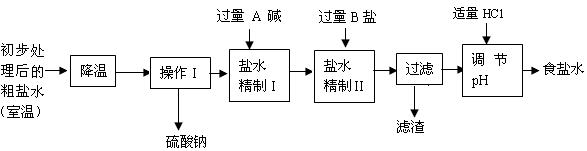
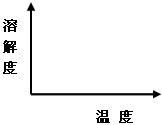
(2)通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图。
(3)“精制I”操作中,加入过量含钙元素的碱的化学式是 。其反应化学方程式为 。
(4)“精制II”操作中,加入B盐的有关反应方程式为 。
(5)为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告。
(4)“精制II”操作中,加入B盐的有关反应方程式为 。
(5)为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告。

(6)查阅资料得知NaCl 、NH4HCO3、 NaHCO3 、NH4Cl在30℃时的溶解度如下表所示:
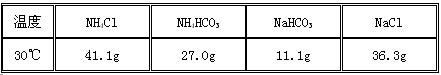
请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式: 。
第三步处理制得碳酸钠,反应原理为2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
查看习题详情和答案>>
第三步处理制得碳酸钠,反应原理为2NaHCO3
 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑ 纯碱(Na2CO3)产品中常含有少量氯化钠。某厂生 产的纯碱包装袋上标有“Na2 CO3含量≥95%”字样。为判断该产品中Na2CO3的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图。其中,丙装置中装足量浓氢 氧化钠溶液,丁装置中装浓硫酸,戊装置中装水。(提示:浓 硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解。)
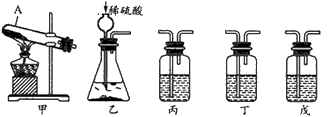
(1)写出上图仪器A的一种常见用途_____________。
(2)你选择的实验装置从左到右组装排列为____________(填编号.) 。请说出你选择或排列装置的一点理由________________。
(3)假设每步都反应完全,生成的二氧化碳全部被吸收,不考虑空气中二氧化碳的影响。要通过较准确地计算判断 “Na2CO3含量≥95%”是否真实,该实验除称取样品质量外,还要用天平称量得到的实验数据是_________ 。
(4)若乙装置中加入浓盐酸(有挥发性),对测量结果有影响。原因是浓盐酸挥发出的氯化氢气体_____________ 。
(5)若实验装置连接正确,实验过程中看到丙装置出现的气泡比丁少得多,一种可能的原因是_________。
查看习题详情和答案>>
(2)你选择的实验装置从左到右组装排列为____________(填编号.) 。请说出你选择或排列装置的一点理由________________。
(3)假设每步都反应完全,生成的二氧化碳全部被吸收,不考虑空气中二氧化碳的影响。要通过较准确地计算判断 “Na2CO3含量≥95%”是否真实,该实验除称取样品质量外,还要用天平称量得到的实验数据是_________ 。
(4)若乙装置中加入浓盐酸(有挥发性),对测量结果有影响。原因是浓盐酸挥发出的氯化氢气体_____________ 。
(5)若实验装置连接正确,实验过程中看到丙装置出现的气泡比丁少得多,一种可能的原因是_________。
纯碱在玻璃、洗涤剂等工业上广泛应用,著名化学家侯德榜对改进它的生产技术做出杰出贡献。运用侯氏制碱法制得的纯碱可能含有少量的氯化钠,现取含有少量的氯化钠杂质的纯碱样品5g与足量的稀盐酸完全反应,放出1.76g气体。请计算,这种纯碱样品中碳酸钠的质量分数?
查看习题详情和答案>>
纯碱在玻璃、洗涤剂等工业上广泛应用,著名化学家侯德榜对改进它的生产技术做出杰出贡献。运用侯氏制碱法制得的纯碱可能含有少量的氯化钠,现取含有少量的氯化钠杂质的纯碱样品5g与足量的稀盐酸完全反应,放出1.76g气体。请计算,这种纯碱样品中碳酸钠的质量分数?
查看习题详情和答案>>纯碱(![]() )产品中常含有少量氯化钠。某厂生产的纯碱包装袋上标有“
)产品中常含有少量氯化钠。某厂生产的纯碱包装袋上标有“![]() 含量≥95%”字样。为判断该产品中
含量≥95%”字样。为判断该产品中![]() 的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图。其中,丙装置中装足量浓氢氧化钠溶液,丁装置中装浓硫酸,戊装置中装水。(提示:浓硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解。)
的含量是否达到要求,称取5.0g样品进行检验,可供选取的装置如下图。其中,丙装置中装足量浓氢氧化钠溶液,丁装置中装浓硫酸,戊装置中装水。(提示:浓硫酸具有吸水性,不挥发,不与二氧化碳反应,碳酸钠受热不分解。)
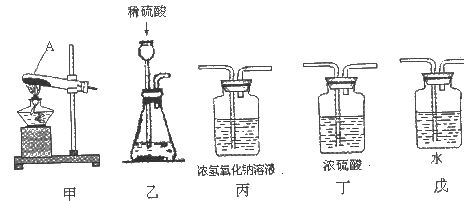
(1)写出上图仪器A的一种常见用途___________。
(2)你选择的实验装置从左到右组装排列为(填编号)___________。请说出你选择或排列装置的一点理由_________。
(3)假设每步都反应完全,生成的二氧化碳全部被吸收,不考虑空气中二氧化碳的影响。较准确地计算“![]() 含量≥95%”是否真实,该实验除称取样品质量外,还要用天平量得到的实验数据是 _________。
含量≥95%”是否真实,该实验除称取样品质量外,还要用天平量得到的实验数据是 _________。
(4)若乙装置中加入浓盐酸(有挥发性),对测量结果会产生影响。原因是浓盐酸挥发出的氯化氢气体__________。
(5)若实验装置连接正确,实验过程中看到丙装置出现的气泡比丁少得多,一种可能的原_____________。
查看习题详情和答案>>