摘要:37.氨气(化学式NH3)是一种具有刺激性气味的气体.极易溶于水.其水溶液易挥发.呈碱性.如果实验室要收集一瓶氨气.应采取的收集方法是 .用湿润的pH试纸伸入集气瓶中.试纸呈 色.我国著名的化学家 先生发明的制碱原理为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl.用 的方法可以把NaHCO3晶体从混合物中分离出来.在制取NaHCO3时.先向饱和的NaCl溶液中通入较多的NH3.再通入足量的CO2的目的是 .
网址:http://m.1010jiajiao.com/timu_id_883861[举报]
(2006?淄博)氨气(化学式NH3)是一种具有刺激性气味的气体,极易溶于水,其水溶液易挥发、呈碱性.如果实验室要收集一瓶氨气,应采取的收集方法是
查看习题详情和答案>>
向下排空气法
向下排空气法
,用湿润的pH试纸伸入集气瓶中,试纸呈蓝
蓝
色.我国著名的化学家侯德榜
侯德榜
先生发明的制碱原理为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,用过滤
过滤
的方法可以把NaHCO3晶体从混合物中分离出来,在制取NaHCO3时,先向饱和的NaCl溶液中通入较多的NH3,再通入足量的CO2的目的是使CO2更易被吸收
使CO2更易被吸收
.氨气(NH3)在通常状况下是一种有刺激性气味的气体,密度比空气小,极易溶于水,其水溶液为氨水.实验室可用加热氯化铵和熟石灰两种固体混合物的方法制取氨气.
(1)实验室制取氨气可选用初中化学中制取
(2)氨气是一种显碱性的气体,为了证明氨气跟氢气一样(加热时)也是具有还原性的一种气体,实验装置如下图.

将氨气通入装有某种黑色粉末的玻璃管(A)中,加热,当黑色粉末全部转化成光亮的红色粉末时,U型管(B)的固体变成蓝色,同时集气瓶(C)中收集到一种无色气态单质X.实验测得数据如下表.
回答下列问题:
①(A)中反应的化学方程式为
②单质X用排水法收集的理由
③取从(C)中排出的水1~2ml放入试管中,滴入1~2ml无色酚酞试液后,溶液呈
④假若从b导管中排出的尾气中含有少量的氨气,除了用水处理的方法外,还可用
⑤在此反应中,生成光亮的红色物质的质量为
查看习题详情和答案>>
(1)实验室制取氨气可选用初中化学中制取
氧气
氧气
的发生装置,理由是反应物的状态和反应条件属于固体加热型
反应物的状态和反应条件属于固体加热型
.(2)氨气是一种显碱性的气体,为了证明氨气跟氢气一样(加热时)也是具有还原性的一种气体,实验装置如下图.

将氨气通入装有某种黑色粉末的玻璃管(A)中,加热,当黑色粉末全部转化成光亮的红色粉末时,U型管(B)的固体变成蓝色,同时集气瓶(C)中收集到一种无色气态单质X.实验测得数据如下表.
| 实 验 前 | 实 验 后 | |
| 黑色粉末+玻璃管 | 65.6g | 59.2g |
| 无水硫酸铜+U形管 | 100.8g | 108.0g |
①(A)中反应的化学方程式为
2NH3+3CuO
3Cu+N2+3H2O
| ||
2NH3+3CuO
3Cu+N2+3H2O
.
| ||
②单质X用排水法收集的理由
氮气不易溶于水
氮气不易溶于水
.③取从(C)中排出的水1~2ml放入试管中,滴入1~2ml无色酚酞试液后,溶液呈
红
红
色,这是由于未完全反应的氨气会随氮气排出,溶于水显碱性,碱溶液使酚酞试液变红
未完全反应的氨气会随氮气排出,溶于水显碱性,碱溶液使酚酞试液变红
.④假若从b导管中排出的尾气中含有少量的氨气,除了用水处理的方法外,还可用
硫酸
硫酸
溶液进行处理,避免氨污染空气.⑤在此反应中,生成光亮的红色物质的质量为
25.6
25.6
g.
氨气(NH3)在通常状况下是一种有刺激性气味的气体,密度比空气小,极易溶于水,其水溶液为氨水.实验室可用加热氯化铵和熟石灰两种固体混合物的方法制取氨气.
(1)实验室制取氨气可选用初中化学中制取 的发生装置,理由是 .
(2)氨气是一种显碱性的气体,为了证明氨气跟氢气一样(加热时)也是具有还原性的一种气体,实验装置如下图.
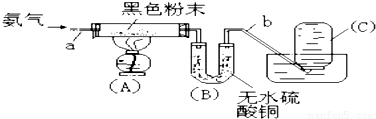
将氨气通入装有某种黑色粉末的玻璃管(A)中,加热,当黑色粉末全部转化成光亮的红色粉末时,U型管(B)的固体变成蓝色,同时集气瓶(C)中收集到一种无色气态单质X.实验测得数据如下表.
回答下列问题:
①(A)中反应的化学方程式为 .
②单质X用排水法收集的理由 .
③取从(C)中排出的水1~2ml放入试管中,滴入1~2ml无色酚酞试液后,溶液呈 色,这是由于 .
④假若从b导管中排出的尾气中含有少量的氨气,除了用水处理的方法外,还可用 溶液进行处理,避免氨污染空气.
⑤在此反应中,生成光亮的红色物质的质量为 g. 查看习题详情和答案>>
(1)实验室制取氨气可选用初中化学中制取 的发生装置,理由是 .
(2)氨气是一种显碱性的气体,为了证明氨气跟氢气一样(加热时)也是具有还原性的一种气体,实验装置如下图.

将氨气通入装有某种黑色粉末的玻璃管(A)中,加热,当黑色粉末全部转化成光亮的红色粉末时,U型管(B)的固体变成蓝色,同时集气瓶(C)中收集到一种无色气态单质X.实验测得数据如下表.
| 实 验 前 | 实 验 后 | |
| 黑色粉末+玻璃管 | 65.6g | 59.2g |
| 无水硫酸铜+U形管 | 100.8g | 108.0g |
①(A)中反应的化学方程式为 .
②单质X用排水法收集的理由 .
③取从(C)中排出的水1~2ml放入试管中,滴入1~2ml无色酚酞试液后,溶液呈 色,这是由于 .
④假若从b导管中排出的尾气中含有少量的氨气,除了用水处理的方法外,还可用 溶液进行处理,避免氨污染空气.
⑤在此反应中,生成光亮的红色物质的质量为 g. 查看习题详情和答案>>
氨气(NH3)在通常状况下是一种有刺激性气味的气体,密度比空气小,极易溶于水,其水溶液为氨水.实验室可用加热氯化铵和熟石灰两种固体混合物的方法制取氨气.
(1)实验室制取氨气可选用初中化学中制取______的发生装置,理由是______.
(2)氨气是一种显碱性的气体,为了证明氨气跟氢气一样(加热时)也是具有还原性的一种气体,实验装置如下图.

将氨气通入装有某种黑色粉末的玻璃管(A)中,加热,当黑色粉末全部转化成光亮的红色粉末时,U型管(B)的固体变成蓝色,同时集气瓶(C)中收集到一种无色气态单质X.实验测得数据如下表.
回答下列问题:
①(A)中反应的化学方程式为______.
②单质X用排水法收集的理由______.
③取从(C)中排出的水1~2ml放入试管中,滴入1~2ml无色酚酞试液后,溶液呈______色,这是由于______.
④假若从b导管中排出的尾气中含有少量的氨气,除了用水处理的方法外,还可用______溶液进行处理,避免氨污染空气.
⑤在此反应中,生成光亮的红色物质的质量为______g.
查看习题详情和答案>>
(1)实验室制取氨气可选用初中化学中制取______的发生装置,理由是______.
(2)氨气是一种显碱性的气体,为了证明氨气跟氢气一样(加热时)也是具有还原性的一种气体,实验装置如下图.

将氨气通入装有某种黑色粉末的玻璃管(A)中,加热,当黑色粉末全部转化成光亮的红色粉末时,U型管(B)的固体变成蓝色,同时集气瓶(C)中收集到一种无色气态单质X.实验测得数据如下表.
| 实 验 前 | 实 验 后 | |
| 黑色粉末+玻璃管 | 65.6g | 59.2g |
| 无水硫酸铜+U形管 | 100.8g | 108.0g |
①(A)中反应的化学方程式为______.
②单质X用排水法收集的理由______.
③取从(C)中排出的水1~2ml放入试管中,滴入1~2ml无色酚酞试液后,溶液呈______色,这是由于______.
④假若从b导管中排出的尾气中含有少量的氨气,除了用水处理的方法外,还可用______溶液进行处理,避免氨污染空气.
⑤在此反应中,生成光亮的红色物质的质量为______g.
氨气(NH3)是一种无色、有刺激性气味的气体,比空气轻,极易溶于水,其水溶液显碱性.还具有一定的还原性,在加热条件下能与氧化铜反应生成氮气、铜和水.在生产中大量用于制取尿素、铵态氮肥,生产的硝酸铵还可用做致冷剂.
实验室欲用氨气还原氧化铜,装置如图:
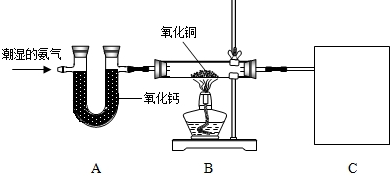
(1)纯净的氨气还原氧化铜效果较好,请写出A装置中所发生反应的化学方程式: ;
(2)请写出B装置中氨气还原氧化铜的化学方程式 ;
(3)B装置中的主要现象为 ;
(4)回忆并模仿实验室的炼铁原理,你认为C中的实验装置应起到什么作用? ;
(5)反应后,若B装置中硬质玻璃管和药品的总质量比反应前减轻了9.6g,请问实际参加反应的氧化铜的质量可能为多少? 查看习题详情和答案>>
实验室欲用氨气还原氧化铜,装置如图:

(1)纯净的氨气还原氧化铜效果较好,请写出A装置中所发生反应的化学方程式:
(2)请写出B装置中氨气还原氧化铜的化学方程式
(3)B装置中的主要现象为
(4)回忆并模仿实验室的炼铁原理,你认为C中的实验装置应起到什么作用?
(5)反应后,若B装置中硬质玻璃管和药品的总质量比反应前减轻了9.6g,请问实际参加反应的氧化铜的质量可能为多少? 查看习题详情和答案>>