题目内容
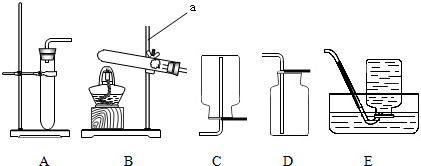
氨气(NH3)是一种无色、有刺激性气味的气体,比空气轻,极易溶于水,其水溶液显碱性.还具有一定的还原性,在加热条件下能与氧化铜反应生成氮气、铜和水.在生产中大量用于制取尿素、铵态氮肥,生产的硝酸铵还可用做致冷剂.实验室欲用氨气还原氧化铜,装置如图:
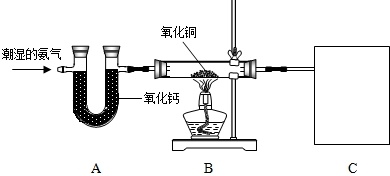
(1)纯净的氨气还原氧化铜效果较好,请写出A装置中所发生反应的化学方程式:
(2)请写出B装置中氨气还原氧化铜的化学方程式
(3)B装置中的主要现象为
(4)回忆并模仿实验室的炼铁原理,你认为C中的实验装置应起到什么作用?
(5)反应后,若B装置中硬质玻璃管和药品的总质量比反应前减轻了9.6g,请问实际参加反应的氧化铜的质量可能为多少?
分析:(1)装置A中盛放的氧化钙能吸收潮湿氨气中的水,与水反应生成氢氧化钙;
(2)干燥的氨气在加热条件下与氧化铜反应,根据题意可知,生成氮气、铜和水;
(3)氧化铜被还原成铜,因此可观察到黑色氧化铜变成红色铜;
(4)未完全反应的氨气随反应后的气体排出,为防止有刺激性气味的氨气对环境造成污染,应对尾气进行处理;
(5)反应前的氧化铜变成铜,因此B装置中硬质玻璃管和药品的总质量比反应前减轻了9.6g为氧化铜中氧的质量,由氧化铜中氧的质量计算氧化铜的质量.
(2)干燥的氨气在加热条件下与氧化铜反应,根据题意可知,生成氮气、铜和水;
(3)氧化铜被还原成铜,因此可观察到黑色氧化铜变成红色铜;
(4)未完全反应的氨气随反应后的气体排出,为防止有刺激性气味的氨气对环境造成污染,应对尾气进行处理;
(5)反应前的氧化铜变成铜,因此B装置中硬质玻璃管和药品的总质量比反应前减轻了9.6g为氧化铜中氧的质量,由氧化铜中氧的质量计算氧化铜的质量.
解答:解:(1)氧化钙吸收水生成氢氧化钙,反应的化学方程式为CaO+H2O═Ca(OH)2;
(2)在加热条件下氨气能与氧化铜反应生成氮气、铜和水,故反应的化学方程式为2NH3+3CuO
3Cu+N2+3H2O;
(3)装置内的氧化铜被还原成铜,可观察到:黑色固体出现红色;
(4)装置C吸收未完全反应的氨气,防止氨气污染环境,因此,C中的实验装置应起到吸收尾气、保护环境的作用;
故答案为:
(1)CaO+H2O═Ca(OH)2;(2)2NH3+3CuO
3Cu+N2+3H2O;(3)黑色固体出现红色;(4)吸收尾气,保护环境;
(5)根据B装置中硬质玻璃管和药品的总质量比反应前减轻了9.6g,可知被还原氧化铜中氧元素质量为9.6g,
则实际参加反应的氧化铜的质量=9.6g÷
×100%=48g
答:实际参加反应的氧化铜的质量可能为48g.
(2)在加热条件下氨气能与氧化铜反应生成氮气、铜和水,故反应的化学方程式为2NH3+3CuO
| ||
(3)装置内的氧化铜被还原成铜,可观察到:黑色固体出现红色;
(4)装置C吸收未完全反应的氨气,防止氨气污染环境,因此,C中的实验装置应起到吸收尾气、保护环境的作用;
故答案为:
(1)CaO+H2O═Ca(OH)2;(2)2NH3+3CuO
| ||
(5)根据B装置中硬质玻璃管和药品的总质量比反应前减轻了9.6g,可知被还原氧化铜中氧元素质量为9.6g,
则实际参加反应的氧化铜的质量=9.6g÷
| 16 |
| 80 |
答:实际参加反应的氧化铜的质量可能为48g.
点评:根据题目对氨气的介绍信息,结合实验装置图,迁移已有知识判断各装置的作用及发生的反应,完成问题的解答.

练习册系列答案
相关题目