网址:http://m.1010jiajiao.com/timu_id_76994[举报]
15、(10分)
⑴结构式(1分);测定pH 或滴加Na2CO3溶液 或将甲酸滴加到滴有酚酞的NaOH溶液中(不能用Na,其它合理答案均可得分)(2分)
⑵(2分)测定HCOONa溶液的pH;或将等pH的HCOOH溶液和HCl溶液稀释相同倍数,测其pH的变化;或比较等浓度甲酸和盐酸的导电性等(合理均可给分)
⑶(2分)出现银镜,由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质(1分。羧基中C原子和2个O原子之间形成1个大л键,而使甲酸分子中的醛基性质不太典型);或答稀氨水量不足,使甲酸与银氨溶液混合后仍显酸性(1分)
⑷ ① 甲酸在浓硫酸的作用下脱水生成CO和H2O(1分)
 ②(2分)
②(2分)
16、(8分 每空1分)
 (1)
离子键、共价键(或非极性键)
(1)
离子键、共价键(或非极性键)
(2)FeS2 -1 (3)Fe2O3+6H+=2Fe3++3H2O Fe2(SO4)3+6KOH=2Fe(OH)3↓+3K2SO4
(4)Cu-2e=Cu2+ (5) 852
17. (12分)(1)SO2+NaOH=NaHSO3 (1分) HSO3-+H+==SO2+H2O (1分)
 (2) AB
(2分) 实验时间和加入盐酸酸化的氯化钡溶液后生成沉淀的质量 (2分)
(2) AB
(2分) 实验时间和加入盐酸酸化的氯化钡溶液后生成沉淀的质量 (2分)
 (3)变废为肥,充分利用资源,降低污染 (2分)
(3)变废为肥,充分利用资源,降低污染 (2分)
 (4)+4 (2分)
(4)+4 (2分)
 (5)5CH3OH+6NO3--+6H+ ==5CO2+3N2+13H2O (2分)
(5)5CH3OH+6NO3--+6H+ ==5CO2+3N2+13H2O (2分)
18.(共8分,每空2分)
(1)3NaClO3+3H2SO4=2ClO2↑+HClO4+H2O+3NaHSO4
或 3NaClO3+2H2SO4=2ClO2↑+NaClO4+H2O+2NaHSO4
(2)二氧化硫作为还原剂把ClO2还原为NaClO2
2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O
(3)H2SO4
19.(12分)


 ⑴
(或
),
(2分,各1分)
⑴
(或
),
(2分,各1分)
 ⑵
(2分)
⑵
(2分)

(3分)
⑶ ④、⑤、⑥ (写对一个得一分,错一个扣一分,扣完为止,3分)
⑷ ①、③ (2分,各1分)
20. (10分)(1).2.8×105 ;18
(2).86.96% (3). ;138
;138
21、(12分)⑴分子 (2分) 1s2s22p63s23p63d84s2或[Ar]3d84s2 (2分)
⑵ACD (2分) ⑶①、③、④ (2分) 平面三角 (2分)
⑷LaNi5或Ni5La (2分)
I.将0.050molSO2和0.030molO2放入容积为 2SO3(g)
;△H=-196.6kJ?mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932 kJ的热量,则容器A中SO2的平衡转化率为
;容器B中SO2的平衡转化率(填“大于”、“小于”或“等于”)
2SO3(g)
;△H=-196.6kJ?mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932 kJ的热量,则容器A中SO2的平衡转化率为
;容器B中SO2的平衡转化率(填“大于”、“小于”或“等于”)
容器A中SO2的平衡转化率;达到平衡的时间(填“A”或“B”) 容器比较短;
II.滴定分析法是化学分析法中的重要分析方法之一。滴定分析法就是将一种已知准确浓度的试剂溶液(即标准溶液),由滴定管滴加到被测定的物质的溶液(即试液)中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积,就可以求得被测组分的含量。
(1) 已知用0.10 mol/L HCl滴定 20.00ml
0.10 mol/L Na2CO3的滴定曲线如右图所示:
 ① A处选用
作指示剂比较合适;
① A处选用
作指示剂比较合适;
② 当滴定至混合液pH接近4时,为了防止
终点出现过早,减少实验的误差,应剧烈地
摇动溶液或加热一会溶液,冷却后再继续滴
定,这样做的理由是:
;
如果是采用加热溶液的操作,应如何进行?
;
(2)(2)EDTA是乙二胺四乙酸的英文名称的缩写,
它是一种常用的滴定剂,市售试剂是其二水合二钠
盐。下表是EDTA与一些常见金属离子形成络合物
(用MY表示)的稳定常数(温度25oC):
阳离子
lgKMY
阳离子
lgKMY
Na+
1.66
Mn2+
13.87
Ca2+
10.96
Pb2+
18.04
lgKMY值越大,表明金属离子与EDTA形成的络合物越稳定,越难电离
根据上表给出的数据和你所学的知识,解释为什么用CaY溶液可以排除体内的铅?
___________________________________________________________________________。
23.(12分)
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]为测定硫元素的含量
Ⅰ.将m 2Fe2O3+8SO2
2Fe2O3+8SO2
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:
问题讨论:
⑴.Ⅰ中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有_________________、_________________。
⑵.Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是_____________。
⑶.该黄铁矿中硫元素的质量分数为______________。
[实验二]设计以下实验方案测定铁元素的含量

问题讨论:
⑷.③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有__________。
⑸.②中,若选用铁粉作还原剂,你认为合理吗?理由是:____________。
五、(本题包括1小题,9分)
25.(9分)
咖啡酸苯乙酯 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化:
请填写下列空白。
⑴.D分子中的官能团是________。
⑵.高分子M的结构简式是______________。
⑶.写出A→B反应的化学方程式:___________________。
⑷.B→C发生的反应类型有______________。
⑸.A的同分异构体很多种,其中,同时符合下列条件的同分异构体有____种。
①苯环上只有两个取代基;
②能发生银镜反应;
③能与碳酸氢钠溶液反应;
④能与氯化铁溶液发生显色反应。
(10分)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的贫菱锰矿(MnCO3含量较低)转化为高品位“菱锰矿砂”(MnCO3含量高)的绿色工艺。该工艺流程如下图所示:

已知焙烧反应①的化学方程式:(NH4)2SO4+MnCO3MnSO4+2NH3↑+CO2↑+H2O。
(1)写出反应②的离子方程式_______________________________________。
(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、____________、__________。从物料平衡角度看,理论上生产过程中_________(填“需要”或者“不需要”)添加(NH4)2SO4。
(3)向物质的量浓度均为0.01mol?L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的是________(填离子符号);当两种沉淀共存时,溶液中 =________。
=________。
[Ksp(BaCO3)=8.1×10-9,Ksp(MnCO3)=1.8×10-11]
(10分)(1)Mn2++2NH3+CO2+H2O=2NH4++MnCO3↓(2分)
(2)NH3、CO2 (2分) 不需要(2分)
(3)Mn2+(2分) 450(2分)
www.ks5u.com
教师提醒:它由Cu、Fe2O3、Fe(OH)3三种固体中的一种或两种组成.
提出猜想:红色粉末可能的组成有:
①只有Cu ②只有Fe2O3
③只有Fe(OH)3④是Fe2O3、Fe(OH)3的混合物
⑤是Cu、Fe2O3的混合物 ⑥是Cu、Fe(OH)3的混合物
资料获悉:(1)2Fe(OH)3
| ||
(2)白色无水CuSO4遇水变蓝
(3)Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
探究思路:利用物质的性质不同设计实验加以甄别,先分别探究其中是否含有Fe(OH)3、Cu等,逐步缩小范围,然后再选择适当的试剂和方法通过实验探究其组成.
(装置内空气中的水蒸气、CO2忽略不计)
实验探究:
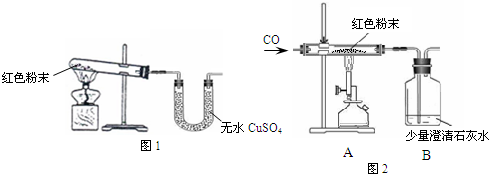
(1)甲同学取适量红色粉末装入试管中,按图1进行实验.结果无水CuSO4没有变蓝,从而排除猜想中的
(2)在甲同学实验结论的基础上,乙同学另取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解,溶液变色.乙同学认为可以排除猜想中的①和⑤,而丙同学认为只能排除猜想①,你认为
(3)丁同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按图2在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
| 反应前 | 反应后 | |
| Ⅰ 组 |
玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ 组 |
洗气瓶和所盛溶液 的总质量为180.0g |
洗气瓶和瓶中物质 的总质量为183.1g |
(1)在装置A中先通CO气体的作用是
(2)应该选择
(3)写出A装置中发生反应的化学方程式
(4)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?
反思评价:戊同学指出:从环保角度,图2装置有严重不足之处.你认为应该如何改进?
拓展延伸:有同学提出丁同学上述实验中的CO还可以用H2代替,并将图28-2中B装置换成盛有碱石灰(生石灰和氢氧化钠固体混合物)的干燥管,来确定该红色粉末的组成,你认为是否可行?
某化学兴趣小组有一次活动的内容是:对一包干燥的红色粉末组成进行探究.请你参与并回答有关问题.
教师提醒:它由Cu、Fe2O3、Fe(OH)3三种固体中的一种或两种组成.
提出猜想:红色粉末可能的组成有:
①只有Cu ②只有Fe2O3
③只有Fe(OH)3④是Fe2O3、Fe(OH)3的混合物
⑤是Cu、Fe2O3的混合物 ⑥是Cu、Fe(OH)3的混合物
资料获悉:(1)2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
(2)白色无水CuSO4遇水变蓝
(3)Cu在FeCl3溶液中发生反应:2FeCl3+Cu=2FeCl2+CuCl2
探究思路:利用物质的性质不同设计实验加以甄别,先分别探究其中是否含有Fe(OH)3、Cu等,逐步缩小范围,然后再选择适当的试剂和方法通过实验探究其组成.
(装置内空气中的水蒸气、CO2忽略不计)
实验探究:

(1)甲同学取适量红色粉末装入试管中,按图1进行实验.结果无水CuSO4没有变蓝,从而排除猜想中的______.(填猜想中的序号)
(2)在甲同学实验结论的基础上,乙同学另取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解,溶液变色.乙同学认为可以排除猜想中的①和⑤,而丙同学认为只能排除猜想①,你认为______的观点正确(填“乙”“丙”).
(3)丁同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按图2在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
| 反应前 | 反应后 | |
| Ⅰ 组 | 玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
| Ⅱ 组 | 洗气瓶和所盛溶液 的总质量为180.0g | 洗气瓶和瓶中物质 的总质量为183.1g |
(1)在装置A中先通CO气体的作用是______.
(2)应该选择______组的实验数据计算来确定红色粉末的组成.最终计算结果表明:该红色粉末的组成是猜想中的第______组(填序号).
(3)写出A装置中发生反应的化学方程式______;实验中观察到A装置中的现象为______.
(4)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?______(填“需要”或“不需要”),理由是______.
反思评价:戊同学指出:从环保角度,图2装置有严重不足之处.你认为应该如何改进?______.
拓展延伸:有同学提出丁同学上述实验中的CO还可以用H2代替,并将图28-2中B装置换成盛有碱石灰(生石灰和氢氧化钠固体混合物)的干燥管,来确定该红色粉末的组成,你认为是否可行?______(填“可行”或“不可行”). 查看习题详情和答案>>
A.滴定用的锥形瓶和滴定管都要用所盛溶液润洗
B.在粗盐的提纯实验中,溶解、过滤、蒸发都用到了玻璃棒
C.配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高
D.配制FeCl3溶液时,将FeCl3固体溶于较浓盐酸中,然后再用水稀释到所需的浓度E.在铁粉存在下用溴水和苯反应制取溴苯时,无需加热
F.取1mL 20%蔗糖溶液,加入适量稀硫酸,水浴加热约5min后,再加入少量新制的Cu(OH)2,悬浊液加热,可检验蔗糖是否发生了水解
G.物质溶于水的过程中,一般有放热或吸热现象,若热效应不明显,溶解的操作可以在量筒中进行
Ⅱ在中学化学实验中,通常用无水硫酸铜来检验少量水的存在,然而,无水硫酸铜的吸湿性很强,需要时须现制现用.
方法Ⅰ:取2药匙细小的硫酸铜晶体置于
方法Ⅱ:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
【交流与讨论】
(1)方法Ⅰ中,加热温度稍高时会出现变黑现象,原因是
| ||
| ||
| ||
| ||
(2)方法Ⅱ中,浓硫酸的作用是
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想
(1)欲量取20.00mL Na2CO3溶液,应选用的仪器是
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、
(3)在测定硫酸铜晶体中含量的实验中,称量操作至少要进行
Ⅱ.氢氧化铜是一种常用试剂.例如,利用新制氢氧化铜验证醛类物质的还原性.
(1)新制氢氧化铜悬浊液的配制,实验室制取氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2mL,滴入2%的硫酸铜溶液4~6滴,振荡即成.这样操作的目的是
下面是三个研究性学习小组分别从不同层面开展的研究性学习活动:
(2)研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜.为了确定红色沉淀的成分,开展了如下研究:提出猜想:
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应:③在空气中灼烧氧化亚铜生成氧化铜.
设计方案:方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣
方案3:称取红色沉淀ag,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称重,反复多次至到固体恒重,称得质量为bg,比较a,b关系
方案4:取红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出.
你认为合理的方案是
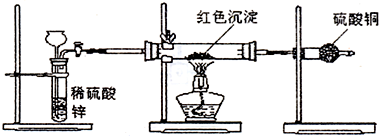
(3)研究性学习小组乙针对小组甲的质疑,设计新的探究方案,装置如图所示.你认为要测定上述红色沉淀成分必须测定下列哪些物理量(只填序号):
①通入氢气体积;②反应前,红色沉淀+硬质玻璃管的总质量;③完全反应后红色固体+硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量
(4)研究性学习小组丙上网查阅新闻得知,“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”.绿色化学强调对环境友好,实现零排放.“变废为宝”符合绿色化学要求.他们收集上述红色沉淀制备化学试剂-蓝矾.请你帮助他们设计一个简单且符合绿色化学要求的实验方案: