网址:http://m.1010jiajiao.com/timu_id_76207[举报]
一、选择题:1.B 2. B 3. C 4.C 5. A 6.A 7.D 8. C 9. B 10. A
11.B 12. D 13. C 14. C 15. B
二、选择题:16. C 17. C 18. B 19. AC 20. D 21. ABD 22. BD
23.(12分) (1)实物连结如右图(4分)
(2)9.0 10 (每空2分) (3) 9.0 11 (每空2分)
24.(15分)
-----理科综合.files/image205.jpg) 解:(1)从A到B的过程中,人与雪橇损失的机械能为:
解:(1)从A到B的过程中,人与雪橇损失的机械能为:
-----理科综合.files/image207.gif)
代入数据解得:-----理科综合.files/image209.gif)
(2)人与雪橇在BC段做减速运动的加速度大小:
-----理科综合.files/image211.gif)
根据牛顿第二定律:-----理科综合.files/image213.gif)
解得:-----理科综合.files/image215.gif)
由动能定理得:-----理科综合.files/image217.gif)
代入数据解得;-----理科综合.files/image219.gif)
25.(18分)解:(1)小球从M到N有-----理科综合.files/image221.gif)
解得-----理科综合.files/image223.gif)
(2)小球从M点到达N点所用时间-----理科综合.files/image225.gif)
小球从N点经过-----理科综合.files/image227.gif) 个圆周,到达P点,所以
个圆周,到达P点,所以-----理科综合.files/image229.gif)
小球从P点到D点的位移-----理科综合.files/image231.gif)
-----理科综合.files/image233.jpg) 小球从P点到D点的时间为
小球从P点到D点的时间为-----理科综合.files/image235.gif)
所以:时间-----理科综合.files/image237.gif)
(或-----理科综合.files/image239.gif) )
)
(3)小球运动一个周期的轨迹如图所示
小球的运动周期为-----理科综合.files/image241.gif) (或
(或-----理科综合.files/image243.gif) )
)
26.(14分)
(1)♂aaBb×♀Aabb (2分) (2)aaBB、AAbb(2分)
(3)①选取正常植株的花粉,进行花药离体培养,得到单倍幼苗;(2分)
②用适宜浓度的秋水仙素溶液处理单倍体玉米幼苗,得到纯合体二倍玉米植株,表现型为正常珠、雄珠、雌珠。(4分)
③选取多珠雌珠玉米和雄珠玉米分别杂交;若杂交后只有正常珠,则亲本为符合生产要求的纯合体雌珠和雄珠;若后代有雌珠和雄珠,则亲本为不符合要求的纯合体雌珠和雄珠。(4分)
27.(19分)
I.(1)胰岛A细胞(1分) [b]胰高血糖素(1分) [a]胰岛素(1分)
血糖的转化与利用(2分) 抑制非糖物质转化为血糖和肝糖原的分解(2分)
(2)反馈调节(2分)
(3)细胞膜上的受体蛋白不正常(a激素不能与受体结合或控制细胞膜上的受体蛋白的基因发生突变所致)(2分)
II.(1)(在光照强度为零时)小球藻呼吸作用吸收的氧气量(2分)
(2)呼吸作用吸收的氧气量等于光合作用产生的氧气量(2分)
(3)光照强度(2分)
(4)B试管中缺少镁元素,影响叶绿素的正常合成,其光合作用速率就比A试管低。(2分)
28.(14分)
(1)-----理科综合.files/image245.gif) (1分)
(1分)
-----理科综合.files/image247.gif) (1分)
(1分)
(2)①-----理科综合.files/image116.gif) (1分)
(1分)-----理科综合.files/image118.gif) (1分)(顺序可以颠倒)
(1分)(顺序可以颠倒)
②取适量滤液乙于蒸发皿中加热蒸发至干,将所得固体转移到试管中,塞上带导管的橡皮塞,并将导管插入澄清饱和石灰水,加热,一段时间后,若澄清饱和石灰水变混浊,则说明滤液乙中含有-----理科综合.files/image118.gif) ;另取适量滤液乙于试管中,加入足量的2mol?L-1
;另取适量滤液乙于试管中,加入足量的2mol?L-1-----理科综合.files/image251.gif) 溶液,将产生的沉淀过滤,洗涤后,再加入适量1 mol?L-盐酸,若有气泡产生,则滤液乙中含有
溶液,将产生的沉淀过滤,洗涤后,再加入适量1 mol?L-盐酸,若有气泡产生,则滤液乙中含有-----理科综合.files/image116.gif) 。(3分,其它合理答案也给分)
。(3分,其它合理答案也给分)
(3)-----理科综合.files/image253.gif) 或
或-----理科综合.files/image255.gif) (2分)
(2分)
(4)
-----理科综合.files/image257.gif)
(每个离子方程式1分,共3分)
②图像如下:(2分)
-----理科综合.files/image259.jpg)
29.(12分)(1)-----理科综合.files/image261.gif) ,
,-----理科综合.files/image263.gif) 1分) (2)硫酸,硫酸铵(亚硫酸钠)(1分,其它合理答案也给分)
1分) (2)硫酸,硫酸铵(亚硫酸钠)(1分,其它合理答案也给分)
(3)粗铜(1分) -----理科综合.files/image265.gif) (1分)
(1分)
(4)-----理科综合.files/image267.gif) (2分) 将
(2分) 将-----理科综合.files/image141.gif) 氧化成
氧化成-----理科综合.files/image165.gif) (2分)
(2分) -----理科综合.files/image141.gif) (1分) 否(1分) 根据溶度积,当溶液pH为7~8时,溶液A中
(1分) 否(1分) 根据溶度积,当溶液pH为7~8时,溶液A中-----理科综合.files/image272.gif) 同时生成沉淀而被除去(2分)
同时生成沉淀而被除去(2分)
-----理科综合.files/image274.jpg) 30.(16分)(1)
30.(16分)(1)-----理科综合.files/image276.gif) (2分); 取反应后的溶液少许于洁净的试管中,滴加氯化钡溶液,若有白色沉淀生成,证明有
(2分); 取反应后的溶液少许于洁净的试管中,滴加氯化钡溶液,若有白色沉淀生成,证明有-----理科综合.files/image278.gif) 存在。(或取反应后的溶液少许于洁净的试管中,滴加足量硝酸钡溶液,过滤,在滤液中滴加硝酸银溶液,若有白色沉淀生成证明有
存在。(或取反应后的溶液少许于洁净的试管中,滴加足量硝酸钡溶液,过滤,在滤液中滴加硝酸银溶液,若有白色沉淀生成证明有-----理科综合.files/image280.gif) 存在)(3分)
存在)(3分)
(2)防倒吸(2分) ①(2分)
(3) B、C(1分)
(4)⑤ (2分)品红褪色,加热不复原,说明氯气过量;品红褪色,加热又复原,说明二氧化硫过量。(2分)
31.(8分)【化学―化学与技术】
(1)2-----理科综合.files/image282.gif) (1分)
(1分)
-----理科综合.files/image284.gif) (1分)
(1分)
(反应不写水不扣分)
(2)常压、400―
(3)取少许滤液滴加到盐酸中产生气泡(2分)
(4)a d (2分)
32.(8分)【化学―物质结构与性质】
(1)⑨;分子晶体
(2)< 、>
(3)②>⑤>⑧
(4)-----理科综合.files/image286.gif)
-----理科综合.files/image288.gif) 与分子形成氢键且发生化学反应
与分子形成氢键且发生化学反应
(5)12; 1:2 (该题目每空1分)
33.(8分)【化学―有机化学基础】
(1)加成反应或还原反应(1分) 消去反应(1分)
-----理科综合.files/image290.jpg) (2)HOOCC
(2)HOOCC-----理科综合.files/image292.gif) CCOOH(1分)
CCOOH(1分)
-----理科综合.files/image294.jpg)
34.(8分)(1)蛋白酶 蛋白酶和脂肪酸 加酶和适当提高温度 因为高温使酶失活
(2)固定化酶 (3)平板划线法 (或稀释涂布平板法) 纤维素 (4)萃取法、蒸馏法、压榨法(任选两种)
35.(8分)
(1)目的基因 显微注射法
通过设备检测,发出明亮的绿色荧光细胞即为转基因体细胞 胚胎分割
(2)标记基因 为了鉴定受体细胞中是否含有目的基因
(3)GFD基因(绿色荧光蛋白基因)
预期蛋白质功能→预期蛋白质结构→推测氨基酸序列→推知基因的核苷酸序列→修饰(合成)相应基因→表达出相应蛋白质
36.(8分)【物理―物理3―3】
解:(1)一个分子的直径-----理科综合.files/image296.gif)
由题意得-----理科综合.files/image298.gif)
解得:-----理科综合.files/image300.gif)
(2)① a→b 过程
②理想气体由c到d,温度升高,内能增加;体积增大,对外做功;由热力学第一定律可知气体吸热。
37.(8分)【物理―物理3―4】
解:由图知:入射角-----理科综合.files/image302.gif) 折射角
折射角-----理科综合.files/image304.gif)
-----理科综合.files/image306.gif)
(2)若发生全反射,入射角C应满足
-----理科综合.files/image308.gif)
C=45°
亮斑半径-----理科综合.files/image310.gif)
亮斑面积-----理科综合.files/image312.gif)
38.(8分)【物理―物理3―5】
解:(1)-----理科综合.files/image314.gif)
(2)用-----理科综合.files/image316.gif) 分别表示中子(
分别表示中子(-----理科综合.files/image318.gif) )、氦核(
)、氦核(-----理科综合.files/image320.gif) )和氚核(
)和氚核(-----理科综合.files/image322.gif) )的质量,由动量守恒定律得
)的质量,由动量守恒定律得-----理科综合.files/image324.gif)
代入数值,得-----理科综合.files/image326.gif)
即反应后生成的氚核的速度大小为-----理科综合.files/image328.gif)
方向与反应前中子的速度方向相反
(14分)(1)二氧化硫的催化氧化的过程如图所示,
其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 温度/℃ | 0.1[ | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |

(3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3
 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。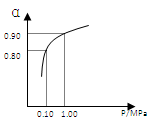
反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,将x mol·L-1的氨水与y mol·L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+) 2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。 查看习题详情和答案>>
(14分)(1)二氧化硫的催化氧化的过程如图所示,

其中a、c二步的化学方程式可表示为:
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
|
压强/MPa 温度/℃ |
0.1[ |
0.5 |
1 |
10 |
|
400 |
99.2% |
99.6% |
99.7% |
99.9% |
|
500 |
93.5% |
96.9% |
97.8% |
99.3% |
|
600 |
73.7% |
85.8% |
89.5% |
96.4% |
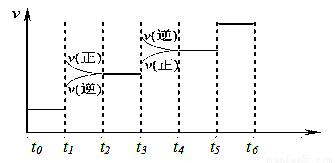
当合成SO3的反应达到平衡后,改变某一外界条件(不改变SO2、O2和SO3的量),反应速率与时间的关系如图所示。图中t1 时引起平衡移动的条件可能是 其中表示平衡混合物中SO3的含量最高的一段时间是 。
(3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。将2.0
mol SO2和1.0
mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10
M Pa。试计算反应2SO3 2SO2+O2 在550 ℃时的平衡常数K=
。
2SO2+O2 在550 ℃时的平衡常数K=
。

反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,将x mol·L-1的氨水与y mol·L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+) 2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
查看习题详情和答案>>
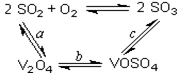
其中a、c二步的化学方程式可表示为:
SO2+V2O5
 SO3+ V2O4
SO3+ V2O4 4VOSO4+O2
 2V2O5+4SO3。
2V2O5+4SO3。该反应的催化剂是 (写化学式)
(2)压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2 7%,O2 11%,N2 82%):
| 压强/MPa 温度/℃ | 0.1[ | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |

(3)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3
 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。
反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)SO3溶于水得到硫酸。在25°C下,将x mol·L-1的氨水与y mol·L-1的硫酸等体积混合,反应后溶液中显中性,则c(NH4+) 2 c(SO42-)(填“>”、“<”或“=”);用含x和y的代数式表示出氨水的电离平衡常数 。
(14分)(1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为:
SO2+V2O5SO3+V2O4
4VOSO4+O22V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO32SO2+O2 在550 ℃时的平衡常数K= 。
(3)550 ℃时,将2.0mol SO2和1.0 mol O2置于5L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O22SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
试填写下列空格:
A容器达到平衡时所需的时间比B容器__ _(填:“短”或“长”);平衡时A容器中SO2的转化率比B容器_______(填:“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。
查看习题详情和答案>>
(14分)(1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为: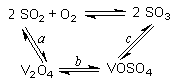
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是 (写化学式)
(2)550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2在550 ℃时的平衡常数K= 。
2SO2+O2在550 ℃时的平衡常数K= 。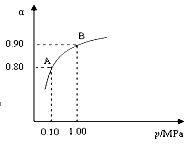
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。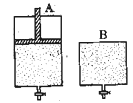
试填写下列空格:
A容器达到平衡时所需的时间比B容器__ _(填:“短”或“长”);平衡时A容器中SO2的转化率比B容器_______(填:“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。