网址:http://m.1010jiajiao.com/timu_id_75413[举报]
生物答案:
1D 2B 3D 4B 5B
30、Ⅰ.(每空1分共计8分)(1)略 叶绿体片层结构薄膜;4
(2)CO2→C4→C3→(CH2O) (3)主动运输
(4)肝糖元 (5)磷脂; 脂蛋白; 合理膳食并注意吃一些含卵磷脂较多的食物
Ⅱ、(每空2分共计18分)(1)①实验前要先测甲、乙鼠的体温 ②实验要有重复性,仅用两只小白鼠进行实验有一定的偶然性
(2)赞同。先做不破坏下丘脑的实验,再做破坏下丘脑的实验,进行自身前后对照 (3)B、D A、C (4)甲状腺激素和肾上腺素 神经―体液 (5)①神经系统兴奋性降低,精神萎靡 ②食欲降低
31.(每空2分共计16分)(1)Bb//Bb、bb (2)BB和bb//Bb (3) 黑、红个体
全为纯合子//黑、红种牛为双亲的一方 (4) B栏中黑色纯合子基因型为BB,只
产生一种B配子,且栏中红色个体均为同一性别 (5) B栏中杂合黑色全为同一
性别,并且与红色个体为同一性别
化学答案:
6.C.7. D.8.B.9.C.10.D.11.C.12.A.13.D.
25.(每空3分)
 ⑴
N2H4(l)+2H2O2(l)==N2(g)+4H2O(g);△H= ―817.6KJ/mol
⑴
N2H4(l)+2H2O2(l)==N2(g)+4H2O(g);△H= ―817.6KJ/mol
CO2、C2H2、N2O(任写两种)
⑵
NH4+ + H2O  NH3 °H2O + H+
NH3 °H2O + H+
26.. Ⅰ①②⑦⑧ (4分)
(每空2分)
Ⅱ(1) 石灰乳原料丰富,成本低 (2) MgCl2(或氯化镁) 过滤 洗涤
 (3)制备干燥的HCl气体 (4)
MgCl2(熔融) Mg
+Cl2↑
(3)制备干燥的HCl气体 (4)
MgCl2(熔融) Mg
+Cl2↑
27.(每空2分)
(1)> (2)增大 (3)=,a=b+c (4) c
(5)>,由于始终保持较大压强,故反应物的转化率较高,生成的C3比恒容时多,则放出的热量也大。
28.(每空3分)
(1) (2)
(2) +2NaOH
+2NaOH
 +2NaBr
+2NaBr
(3) (4)羟基,羧基 (5)(6分)
(4)羟基,羧基 (5)(6分)

或

物理答案:
题号
14
15
16
17
18
19
20
21
答案
BD
C
A
B
D
C
C
BCD
 22.(17分)
22.(17分)
 (1)13.85 (5分)
(1)13.85 (5分)
(2)① (3分)
测量电路如图所示 (3分)
②  (2分)
(2分)
 (2分)
(2分)
③ 建议一:多测几组R、U数据,分别求出相应的I值,用U、I数据作出U―I图线,由图线的截距、斜率求出E、r 。
建议二:由 可推出
可推出 ,多测几组R、U数据,作
,多测几组R、U数据,作 ―
― 图线(为一直线),由图线的截距、斜率求出E、r 。
图线(为一直线),由图线的截距、斜率求出E、r 。
建议三:由 可推出
可推出 ,作
,作 ―
― 图线(为一直线),由图线的截距、斜率求出E、r 。 (2分)
图线(为一直线),由图线的截距、斜率求出E、r 。 (2分)
其他建议合理的同样给分。
因电表选错导致①、②不能得分的,第③题可参照评分标准酌情给分。
23.解:(1)设他们的最大速度为 ,乙的加速度为
,乙的加速度为 ,则
,则
 即
即
于是求得乙接棒时达到最大速度的80%需在接力区须奔跑的距离为
 (2)设乙应在距离甲为
(2)设乙应在距离甲为 时起跑,
时起跑,
由于 , 即
, 即 
所以 
24.解析:(1)当裸导线向左运动到离O点的距离为x, 裸导线中有电流的长度为y,则回路的电动势为: (2分)
(2分)
设回路的周长为L,则回路的总电阻为 (2分)
(2分)
根据欧姆定律可得回路中的电流为: (2分)
(2分)
根据平衡条件得: (2分)
(2分)
根据几何知识求得: ,
, (4分)
(4分)
由以上方程解得: (2分)
(2分)
(2)最终裸导线只能静止在O点,所以裸导线的动能将全部转化为焦耳热. (2分)
即 (3分)
(3分)
25.(20分) 解:(1)(8分)由题意可知:
m 、M之间的最大静摩擦力f=μ(mg+qE)=4N (2分)
m 、M一起运动的最大加速度 (2分)
(2分)
 (2分)
(2分)
 (2分)
(2分)
⑵(12分)








 S=
S=
 A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:
A-F六种元素中,除A外均为短周期元素,它们的原子结构或性质如表所示:| 序号 | 元素 | 结构或性质 | ||
| ① | A | 生活中常见的金属,它有两种氯化物,相对分子质量相差35.5 | ||
| ② | B | 原子最外层电子数是内层电子数的
| ||
| ③ | C | 形成化合物种类最多的元素之一,其单质为固体 | ||
| ④ | D | 地壳中含量最多的元素 | ||
| ⑤ | E | 与D同主族 | ||
| ⑥ | F | 与E同周期,且最外层电子数等于电子层数 |
(2)CD2能与上述某些元素形成的物质发生置换反应,该反应化学方程式是:
(3)F的最高价氧化物对应水化物常用于治疗胃酸(含盐酸)过多症,请写出有关反应的离子方程式:
(4)B与E形成的化合物的电子式是
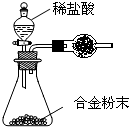
(5)B与F形成的合金是工业上重要的材料.某同学仅使用天平和右图所示的装置测定某些数据即可求出该合金中B元素的含量.
①实验需要测定三个物理量:合金的质量m、a和b.
a是
b是
②干燥管中盛放的试剂最好是
③合金中B元素的质量分数是
|
元素 X的原子比元素Y的原子多一层电子,X、Y的单质都能与水激烈反应放出气体,所生成的两种气体混合点燃,会发生爆炸,X、Y形成的离子都与氖原子有相同的电子层结构,则X、Y可能是 | |
| [ ] | |
A. |
Na和Cl |
B. |
K和F |
C. |
Na和F |
D. |
Ca和Cl |
|
元素X的原子比元素Y的原子多一层电子,X、Y的单质都能与水激烈反应放出气体,所生成的两种气体混合点燃,会发生爆炸,X、Y形成的离子都与氖原子有相同的电子层结构,则X、Y可能是 | |
| [ ] | |
A. |
Na和Cl |
B. |
K和F |
C. |
Na和F |
D. |
Ca和Cl |
 I:氮元素可以形成多种化合物.回答以下问题:
I:氮元素可以形成多种化合物.回答以下问题:(1)基态氮原子的电子排布式是
(2)C、N、O三种元素第一电离能从小到大的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①NH3分子的空间构型是
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ?mol-1若该反应中有2mol N-H键断裂,则形成的π键有
③肼能与硫酸反应生成N2H6SO4.N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在
a.范德华力 b.共价键 c.配位键 d.离子键
II:Fe单质的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为
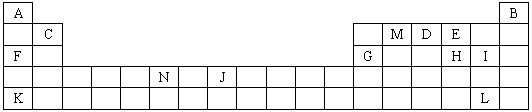
(1)上述所列元素的原子中,最外层电子层上只有两个电子的是
(2)下列叙述正确的是
a.K的最高价氧化物对应的水化物是一种强碱
b.硒化氢的稳定性强于H的氢化物的热稳定性
c.F与H形成化合物水溶液的pH大于F与I形成化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性H弱于I
d.MA2E分子中M原子采取SP2杂化方式
e.N的电子排布式:ls22s22p63s23p63d44s2
f.电负性由大到小的顺序:E>D>M
g.第一电离能由大到小的顺序:E>D>M
(3)预测DA4+离子的空间构型为
(4)向含有CoCl3?5NH3的溶液中加入硝酸银溶液,可析出AgCl沉淀.经测定,每1mol CoCl3?5NH3只生成2molAgCl.
请写出表示此配合物结构的化学式(钴的配位数为6):