网址:http://m.1010jiajiao.com/timu_id_73726[举报]
物理部分
14. B 15. D 16. A 17. D 18. AC 19. C 20. ACD 21. AB
22.I(1)CE (3分)(2) C (3分)
II(1)A D F (每空各1分) (2)略 (6分) (3)1.5 (3分)
23.解:
(1)刹车后小车做匀减速运动,小球继续做匀减速运动,设经过时间.files/image190.gif) ,小球离开小车,判别小车没有停止运动,则
,小球离开小车,判别小车没有停止运动,则.files/image296.gif)
.files/image298.gif)
代入数据可解得:.files/image300.gif)
(2)经判断小球离开小车时,小车已经停止运动。设从刹车到小球落地,小车和小球总位移分别为.files/image302.gif) ,则
,则
.files/image304.gif)
设小球落地时,落点离小车右端的距离为.files/image306.gif) ,则
,则
.files/image308.gif)
解得:.files/image310.gif)
24.解:
(1)设滑块B第一次被弹簧2弹开时速度为.files/image312.gif) 。根据机械能守恒,得
。根据机械能守恒,得
.files/image314.gif) ①
①
第一次A、B共速时速度为.files/image118.gif) ,根据动量守恒
,根据动量守恒.files/image317.gif) ②
②
A、B第一次共速时,弹簧弹性势能最大,设为.files/image319.gif) ,则
,则
.files/image321.gif) ③
③
由①②③可解得:.files/image323.gif) ④
④
(2)设滑块的最终速度分别为,根据能量守恒,有
.files/image325.gif) ⑤
⑤
设弹簧1对滑块A是冲量为.files/image327.gif) ,对滑块A应用动量定理得:
,对滑块A应用动量定理得:
.files/image329.gif) ⑥
⑥
当滑块B最终停止往复运动时应满足:
.files/image331.gif) ⑦
⑦
由⑤⑥⑦可得;.files/image333.gif)
25.解:
(1)电子在电场中做匀加速运动,设离开电场时速度为.files/image118.gif) ,所用时间为
,所用时间为.files/image336.gif) ,根据牛顿定律及运动规律得:
,根据牛顿定律及运动规律得:
.files/image338.gif)
电子从离开电场到进入磁场做匀减速运动,所用时间为.files/image340.gif) ,则
,则.files/image342.gif)
设从电子开始运动到进入云强磁场所需的时间为.files/image190.gif) ,则
,则
.files/image345.gif)
(2)电子在磁场中做圆周运动,京周从磁场出来时,速度应沿竖直方向,在电场中做类平抛运动。设电子穿越电场所需时间为.files/image340.gif) ,偏转距离为
,偏转距离为.files/image132.gif) ,则
,则
.files/image349.gif)
为保证电子从磁场出来后能进入电场并能从电场中出来,电子在磁场中运动的半径R应满足
.files/image351.gif)
电子在磁场中运动轨道半径:.files/image353.gif)
由以上公式可得:.files/image355.gif)
化学部分(共108分)
6. C 7. A 8. B 9. D 10. C 11. A 12. C 13. D
26. (13分)
.files/image357.jpg) (1)硫:
(1)硫:.files/image359.gif)
(2).files/image361.gif)
(3).files/image363.gif)
(4)0.375mol
27.(14分)(1)N溶液中不含.files/image365.gif) (或M溶液中含有
(或M溶液中含有.files/image365.gif) )
)
(2)M
N溶液中含有大量的.files/image368.gif) ,在大量的存在下
,在大量的存在下.files/image370.gif) 与
与.files/image372.gif) 发生氧化还原反应。
发生氧化还原反应。
(3)N
除.files/image374.gif) 外,其它阴离子均存在M溶液中,可以确定
外,其它阴离子均存在M溶液中,可以确定.files/image374.gif) 存在于N溶液中
存在于N溶液中
(4).files/image376.gif)
28.(18分)
(1)未关闭分液漏斗的活塞
(2)①.files/image378.gif)
②无水硫酸铜 检验气体中是否存在水蒸气
③AC
④防止装置C中产生的氯化铜颗粒进入装置E,干扰HCl的检验。
⑤产生白色沉淀
(3)BC
29.(15分)
(1)①②④ .files/image380.jpg) (2)醛基
(2)醛基
(3)CH3-CH2-CH2-CH2-COOH
.files/image382.jpg)
.files/image384.jpg)
生物部分(共72分)
1.C 2. D 3. A 4. B 5. D
30.(24分,每空2分)
I (1)促进细胞分裂和组织分化 休眠 多种激素相互协调、共同调节
(2)增加 减少 有机小分子物质
(3)初期以无氧呼吸为主,随后进行有氧呼吸
(4)受精级核 9
II. (1)①诱导和促进植物细胞的分化(促进植物维管束的分化)
②只能由形态学上端向下端运输
(2)把嫁接的幼芽换成含生长素的琼脂块并没对照,可以观察到同样的现象。
31.(18分)
(1)控制雌蝇1异常眼的基因为隐形基因,位于X染色体上
控制雌蝇2异常眼的基因为显性基因,位于常染色体上
正常眼雌蝇的bbXAY(或aaXBY)
雌蝇1:bbXaXa(或aaXbXb)
雌蝇2:BbXAXA(或AaXBXB)
(2)细胞质遗传
| 成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
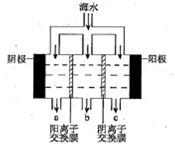
(2)电渗析法淡化海水示意图如图1所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如图2所示:

①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4mol/L.
①饱和Mg(OH)2溶液中滴加酚酞,现象是
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量
海水中主要离子的含量如下:
|
成分 |
含量/(mg/L) |
成分 |
含量/(mg/L) |
|
Cl- |
18980 |
Ca2+ |
400 |
|
Na+ |
10560 |
HCO3- |
142 |
|
SO42- |
2560 |
Mg2+ |
1272 |
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示)______________________________。
(2)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有________和CaCO3,生成CaCO3的离子方程式是_______________。

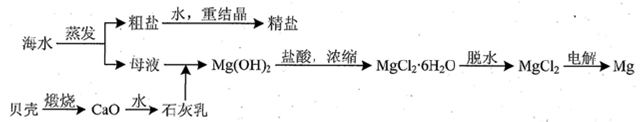
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
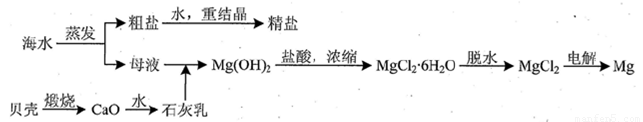
①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是_____。
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2•6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是_________________________。
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L。
①饱和Mg(OH)2溶液中滴加酚酞,现象是___________________________。
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量_________,再加入足量NaOH,将Mg2+转为Mg(OH)2。25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为______%[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以l g/cm3计]。
查看习题详情和答案>>
海水中主要离子的含量如下:
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示)______________________________。
(2)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有________和CaCO3,生成CaCO3的离子方程式是_______________。
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是_____。
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是_________________________。
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L。
①饱和Mg(OH)2溶液中滴加酚酞,现象是___________________________。
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量_________,再加入足量NaOH,将Mg2+转为Mg(OH)2。25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为______%[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以l g/cm3计]。 查看习题详情和答案>>
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
(1)常温下,海水的pH在7.5~8.6之间,其原因是(用离子方程式表示)______________________________。
(2)电渗析法淡化海水示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有________和CaCO3,生成CaCO3的离子方程式是_______________。

(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如下图所示:
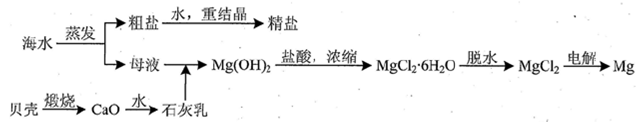
①在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是_____。
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
②由MgCl2溶液得到MgCl2?6H2O晶体时,也需要蒸发,蒸发的目的是得到热饱和溶液,判断溶液已饱和的现象是_________________________。
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L。
①饱和Mg(OH)2溶液中滴加酚酞,现象是___________________________。
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量_________,再加入足量NaOH,将Mg2+转为Mg(OH)2。25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比,相对误差约为______%[保留2位小数,海水中饱和Mg(OH)2溶液的密度都以l g/cm3计]。
 已知(如图所示)①~④均为工业生产及应用中的常见反应.其中常温下B、D、J、P为气体,E为分子中原子个数之比为1:1的液体,M的焰色反应为黄色.A的相对分子质量为120,部分反应的产物已略去.
已知(如图所示)①~④均为工业生产及应用中的常见反应.其中常温下B、D、J、P为气体,E为分子中原子个数之比为1:1的液体,M的焰色反应为黄色.A的相对分子质量为120,部分反应的产物已略去.试回答下列问题:
(1)A的化学式为
(2)反应②的实验中,还需用到的药品是
(3)反应④的化学方程式为
| ||
| ||
(4)P与N反应的产物之一能和K的溶液发生反应,有红褐色沉淀生成.写出该产物与K以物质的量之比为1:2反应的离子方程式: