网址:http://m.1010jiajiao.com/timu_id_70609[举报]
| 4 |
| 7 |
计算并回答:
①10分钟内,Z的平均反应速率为
②计算a 的值(要求有具体过程)
③该条件下X的平衡转化率
④该条件下反应2Z(g)?aX(g)+3Y(g)的平衡常数为
⑤将体积比为 1:3的X和Y的混合气体,通入上述密闭容器中,在一定的条件下发生反应,达到化学平衡时,混合气体中X的体积分数为 w%(w<25),则混合气体中Z的体积分数是
| 25 |
| 50-w |
| 25 |
| 50-w |
Ⅰ.在恒温条件下将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。

(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):
_________________________________________________________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是___________。
Ⅱ.下图是可逆反应X2+3Y2![]() 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是________
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是________

A.t1时,只有正方向反应
B.t2时,反应达到限度
C.t2~t3,反应不再发生
D.t2~t3,各物质的浓度不再发生变化
III.以下是关于化学反应2SO2 + O2 ![]() 2SO3 的两个素材:
2SO3 的两个素材:
素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量

素材2:在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数)

从以上的两个素材中体会:
(1)根据素材1中计算20-30s期间,用二氧化硫表示的化学反应的平均速率为: 。
(2)根据素材2中分析得到,提高该化学反应限度的途径有: 。
(3)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件
是 。
查看习题详情和答案>>CO(g)+H2O(g)
 CO2(g)+H2(g) △H<0。CO和H2O浓度变化如图
CO2(g)+H2(g) △H<0。CO和H2O浓度变化如图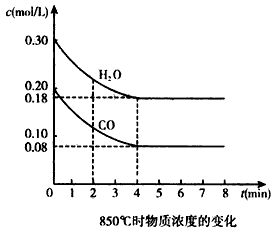
(2)850℃时,平衡常数K=____。
(3)850℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为_______。
(4)能判断该反应达到化学平衡状态的依据是____(填选项序号)。
a.容器中压强不变
b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)
d.c(CO2)=c(CO)
e.容器中气体密度不变
f.1 mol H-H键断裂的同时断裂2 mol H-O键
CO(g)+H2O(g)
 CO2(g)+ H2(g) △H<0。CO和H2O浓度变化如图:
CO2(g)+ H2(g) △H<0。CO和H2O浓度变化如图: 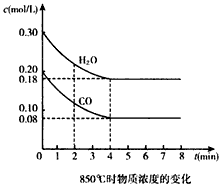
(2)850℃时,平衡常数K=__________。
(3)850℃时,若向该容器中充入1.0 mol CO、3.0mol H2O,则CO的平衡转化率为_________。
(4)能判断该反应达到化学平衡状态的依据是_______(填选项序号)。
a. 容器中压强不变
b. 混合气体中c(CO)不变
c. v正(H2)=v逆(H2O)
d. c(CO2)=c(CO)
e. 容器中气体密度不变
f. 1 mol H-H键断裂的同时断裂2mol H-O键
在一体积为10 L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);ΔH<0.CO和H2O浓度变化如下图:
CO2(g)+H2(g);ΔH<0.CO和H2O浓度变化如下图:
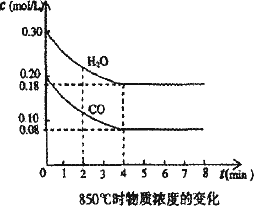
(1)0-4 min的平均反应速率v(CO)=________mol/(L·min).
(2)850℃时,平衡常数K=________.
(3)850℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为________.
(4)能判断该反应达到化学平衡状态的依据是________(填选项序号).
a.容器中压强不变
b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O)
d.c(CO2)=c(CO)
e.容器中气体密度不变
f.1 mol H-H键断裂的同时断裂2 mol H-O键