网址:http://m.1010jiajiao.com/timu_id_6810[举报]
(1)将D2水溶液滴入浅绿色的ZD2溶液中发生反应的离子方程式为
①学生甲认为X2和Y2都可能将Z2+氧化为Z3+,他推理的依据是
②而学生乙认为X2和Y2都不能将Z2+氧化为Z3+;学生丙认为X2能将氧化Z2+为Z3+,而Y2不能.学生乙、丙推理的依据是
(2)A与B可形成既含极性键又含非极性键的化合物W.W的水溶液呈弱酸性,常用作无公害的消毒杀菌剂等.
①W的电子式为


②如果配制W溶液的水中含有Z3+,会削弱W的消毒杀菌能力,甚至会完全失去杀菌作用.试用化学方程式分析其原因:
| ||
| ||
(3)铅(Pb)、锡(Sn)、锗(Ge)与元素C同主族,原子核外电子层数均小于7;常温下其单质,在空气中锡、锗不反应,而铅表面会生成一层氧化铅,锗与盐酸不反应,而锡与盐酸反应.由此可得出以下结论:
①锗的原子序数为
②它们+4价氢氧化物的碱性由强到弱顺序为(填化学式)
(1)X能形成多种常见单质,其熔点最低的单质为___晶体;在熔点最高的两种单质中,X的杂化方式分别为 ____、____。
(2)X、Y分别与氢元素形成的化学键的极性大小为X-H____Y-H,键能大小为X-H____Y-H(填“<”、 “>”或“=”)。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有 I3、I4、I5…,推测Z元素的电离能突增应出现在第___电离能。
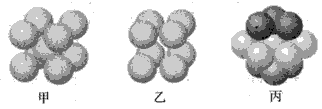
(4)W原子的电子排布式为___;W基态原子有___种不同形状的原子轨道;W晶体的配位数为____;下图___表示的是W晶体中原子的堆积方式(填“甲”、“乙”或“丙”)。
A 、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐M;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,非金属性较强的元素在周期表中的位置为 ,以下三种说法中,可以验证C和E非金属性强弱的是 。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素显负价
c.比较这两种元素的气态氢化物的稳定性
(2)用元素符号表示B,C,D三种元素的第一电离能由大到小的顺序为 。
(3)盐M中含有的化学键类型有
,B的最高价含氧酸N,常温下,若M,N两种溶液的pH均等于5,则由水电离出的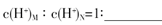
(4)D元素的最高价氧化物对应水化物能与地壳中含量最多的金属元素形成的单质反应,试写出该反应的离子方程式 ,用离子方程式表示该反应生成的盐溶液显碱性的原因
(5)C和D按原子个数比1:1形成一种离子化合物R,已知常温时R与水反应,恢复至原状态测得:每转移1 mol电子放出QkJ的热量,试写出R与水反应的热化学反应方程式 。
查看习题详情和答案>>
A 、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐M;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,非金属性较强的元素在周期表中的位置为 ,以下三种说法中,可以验证C和E非金属性强弱的是 。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素显负价
c.比较这两种元素的气态氢化物的稳定性
(2)用元素符号表示B,C,D三种元素的第一电离能由大到小的顺序为 。
(3)盐M中含有的化学键类型有 ,B的最高价含氧酸N,常温下,若M,N两种溶液的pH均等于5,则由水电离出的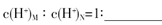
(4)D元素的最高价氧化物对应水化物能与地壳中含量最多的金属元素形成的单质反应,试写出该反应的离子方程式 ,用离子方程式表示该反应生成的盐溶液显碱性的原因
(5)C和D按原子个数比1:1形成一种离子化合物R,已知常温时R与水反应,恢复至原状态测得:每转移1 mol电子放出QkJ的热量,试写出R与水反应的热化学反应方程式 。
(1)C和E两种元素相比较,非金属性较强的元素在周期表中的位置为 ,以下三种说法中,可以验证C和E非金属性强弱的是 。
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素显负价
c.比较这两种元素的气态氢化物的稳定性
(2)用元素符号表示B,C,D三种元素的第一电离能由大到小的顺序为 。
(3)盐M中含有的化学键类型有 ,B的最高价含氧酸N,常温下,若M,N两种溶液的pH均等于5,则由水电离出的
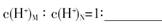
(4)D元素的最高价氧化物对应水化物能与地壳中含量最多的金属元素形成的单质反应,试写出该反应的离子方程式 ,用离子方程式表示该反应生成的盐溶液显碱性的原因
(5)C和D按原子个数比1:1形成一种离子化合物R,已知常温时R与水反应,恢复至原状态测得:每转移1 mol电子放出QkJ的热量,试写出R与水反应的热化学反应方程式 。