网址:http://m.1010jiajiao.com/timu_id_6786[举报]
(一)选择题
1.B 2.D 3.B、D 4.A 5.B、D 6.C 7.B 8.C 9.D 10.C 11.2, 11.A 12.B 13.B 14.B 15.C 16.D 17.A 18.A
(二)非选择题
1.MgH2,酸足量时△1=,酸不足时 Δ1=A-1。AlH2,碱足量时Δ2=,碱不足时Δ2=B-3.
①酸碱均过量时,要使天平平衡需Δ1=Δ2,有的关系,取值范围0<A<12是对的。0<B<27是不对的,因为产生等量H2时 耗Al量比Mg少,故应由B==12.3 75,得0<B<12.375.②酸碱均不足时,并非A=B>12,应是A-1=B-3,即A=B-2,这是关 键,取值范围B>27,A>25而无上限(只需符合A=B-2)。③酸对Mg不足,碱对Al有余时,应为A-1=。取值范围怎样?酸对Mg不足,当然需A>12,这时B应由A-1=算式而定,将A>12代入知B>12.375,故B的取值范围为27>B>1 2.375.而Mg是否为27>A>12?不是的。当B<27时,A应由=A-1决 定,即=A-1得A=25,令B<27,则A<25,A的取值范围为12<A<25。④酸对Mg有余,碱对Al不足时,应有=B-3,而A<12,B>27,可见这种情况是不可能的。
2.(1)80% (2)40%
3.(1)因为在10℃、40℃、75℃时剩余固体量依次减少,所以说明10℃和40℃时溶液一定是 饱和的。
设加入的水为x.
(104-81)∶100=(201-132)∶x,解得x=300 g
(2)在75℃时,混合物中硝酸钠是否全部溶解了?设40℃到70℃时,在300g水中又溶解了y g 硝酸钠。
(150-104)∶100=y∶300,解得y=138 g>(132-72) g
说明硝酸钠在70℃之前就已全部溶解了。
设10℃时300 g水中溶解了z g硝酸钠。
81∶100=z∶300, z=243 g
从10℃到75℃又溶解的硝酸钠:201-72=129(g)
混合物中总共含硝酸钠:243+129=372(g)。
(3)设t℃时硝酸钠恰好溶解在300 g水中,此时硝酸钠的溶解度为S g。
S∶100=372∶300, S=124 g
查硝酸钠溶解度表可得温度为60℃。故完全溶解混合物中硝酸钠所需最低温度为60℃。
4.(1)20 (2)50
5.(1)0.15 mol (2)141.4 g (3)7
6.(1)20% (2)3.93 mol/L (3)4.27 mol
7.有关反应的化学方程式:Zn+FeCl2Fe+ZnCl2
Zn+CuCl2Cu+ZnCl2
(1)根据溶液Cl-的物质的量和反应前后固体的质量变化两关系可求得Fe2+和Cu2+的量。
设FeCl2 x mol,CuCl2y mol,则有
解得:x=,
则[Cu2+]=,
[Fe2+]=。
(2)由于x+y=0.2a mol,且b g Zn粉为过量,则b≥0.2a?65 g,即b≥13a g。
(3)在Cl-的总量一定的情况下,溶液中Cu2+和Fe2+总量也一定,消耗的Zn的总量也不变,所以滤液c的质量越大,则生成的Cu越多,原溶液中CuCl2的含量越大;当原溶液中只含CuCl2时,滤渣c的质量最大。
即Fe2+=0,有b-0.2a-c=0,c=b-0.2a。
8.40.4% (12)n=1 9.(1)2,5
W、W(H2O)
W、W(Cu)
W、V(H2)
W(H2O)、W(Cu)
W(Cu)、V(H2)
(2)
10.(1)1cm3中阴、阳离子总数=()3
1cm3中Ni2+―O2-离子对数=()3×
密度=
(2)解法Ⅰ:设1 mol中含Ni3+x mol, Ni2+(0.97-x)mol。
根据电中性 3x mol +2(0.97-x)mol=2×1 mol ∴x=0.06
Ni2+为(0.97-x)mol=0.91 mol
离子数之比 Ni3+:Ni2+=0.06∶0.91=6∶91
11.(1)M(OH)2+2NaHCO3=MCO3↓+Na2CO3+2H2O (2)②
(3)M的相对原子质量为137,NaHCO3的质量58.8 g
12.(1)2CaO2CaO+O2 (2)80.0% (3)
13.(1)要求由质量、摩尔质量以及体积、浓度分别列出酸和碱的物质的量,再根据中和反应中酸碱物质的量关系列式求得碱的浓度。
∵
∴
(2)在上题求得的基础上,同样利用酸碱中和反应,求得食醋稀释液中CH3COO H的物质的量,经换算后得出C3COOH%的表示式。
∵
∵CH3COOH%=
与第(1)题相比,由于需要经过换算以及正确理解CH3COOH%的含义,所以难度略有上升。
(3)要求学生能迅速接受并理解试题给出的两个信息,据此做出判断。这两条信息是:①由第(1)上题得知,KHC8H4O4可以进一步与NaOH发生中和反应,说明KHC8H4O4溶 液呈酸性(从指示剂颜色变化可知,它与NaHCO3不同,NaHCO3是呈弱碱性的)。②0.1mol /L邻苯二甲酸(H2C8H4O4)溶液的pH大于1,说明溶液的浓度大于电离出的,证明这是弱酸,既然是弱酸,当它完全中和后生成的正盐溶液应呈弱碱性(强碱弱酸盐 水解,溶液呈弱碱性),所以,邻苯二甲酸和KOH溶液混合后,若pH=7,说明邻苯二甲酸和第 一步中和反应(生成KHC8H4O4)已完全,即>1,但第 二步中和反应(KHC8H4O4K2C8H4O4)尚不完全,即<2,现在酸和碱的体积相同,所以在1 ~2之间,即2>x>1,答案为C。
14.(1)SO2+CaCO3+O2+2H2OCaSO4?2H2O+CO 2
SO2+Ca(OH)2+O2+H2OCaSO4?2H2O
(2)=10000×0.0015×24=360(m3)=3.6×105(dm3)
=15276.86(mol)
=15267.86×100=1526786(g)=1.53×103(kg)
(3)=15267.86×172=2626071.92(g)=2.63×103
15.(1)OH-向右移动 Na+向左移动
(2)0.3C 0.3C
(3)2H2O2H2+O2?
(4)电,化学,内,Iεt-I2(R+r)t
(5)(1)0.062(6.2%);4.75mol
(6)19mol
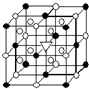 A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子
A.(1)右图所示为冰晶石(化学式为Na3AlF6)的晶胞.图中●位于大立方体顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,▽图中●、○中的一种.图中●、○分别指代哪种粒子(2)H2S和H2O2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(3)向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体.写出铜原子价电子层的电子排布式
B.用含少量铁的氧化铜制取氯化铜晶体(CuCl2?xH2O).有如下操作:
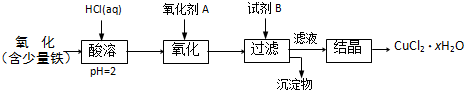
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,Cu2+却不水解.
(1)加热酸溶过程中发生反应的离子方程式有:
(2)氧化剂A可选用
①Cl2 ②KMnO4 ③HNO3
(3)要得到较纯的产品,试剂B可选用
①NaOH ②FeO ③CuO
(4)试剂B的作用是
①提高溶液的pH ②降低溶液的pH ③使Fe3+完全沉淀 ④使Cu2+完全沉淀
(5)从滤液经过结晶得到氯化铜晶体的方法是
①过滤 ②蒸发浓缩 ③蒸发至干 ④冷却
(6)为了测定制得的氯化铜晶体(CuCl2?xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止、冷却、称量所得无水CuCl2的质量为n g.
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g.
试评价上述两种实验方案,其中正确的方案是
| 80m-135n |
| 18n |
| 80m-135n |
| 18n |
A.有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z.E、Q、T三种元素的基态原子具有相同的能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT+2与ET2互为等电子体.X为周期表前四周期中电负性最小的元素,Z的原子序数为28.
请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT+2的电子式


(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有
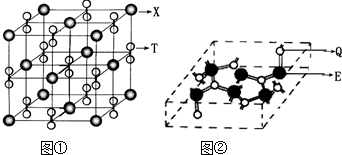
(3)化合物甲由T、X两种元素组成,其晶胞如图①,甲的化学式为
(4)化合物乙的晶胞如图②,乙由E、Q两种元素组成,硬度超过金刚石.
①乙的晶体类型为
②乙的晶体中E、Q两种元素原子的杂化方式均为
B.现有氧化铜和碳粉组成的混合物,为通过实验确定氧化铜的质量分数,某同学设计的实验方案中装置如下:
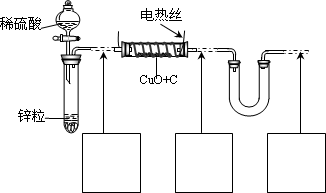
分析上述装置,回答下列问题:
(1)本实验中,酒精灯加热也可达到反应所需的温度,改用电热丝加热的优点是有利于
a.加快反应速率b.氢气流动
c.加热温度更高d.精确测定数据
(2)为确保能准确测定到必要的数据,下列步骤按实验操作顺序排列应为:
a.停止通氢气;b.电热丝通电;c.通入氢气;d.装置气密性检查;e.电热丝停止通电.
(3)为准确测定数据,你认为本装置是否完整?若需要改进,请在虚线下面的方框内画出所需添加的装置示意图并注明必要的物质名称.若无需改进,则将装置图中虚线部分改为实线.
(4)实验结束后,该同学交给老师的实验报告主要栏目如图

(具体内容已略).请你根据实验报告的撰写要求,对此份报告作出评价,若有不完整,请在下面的空格中写出,若已完整,则无需填写.
(5)老师看完实验报告后指出,改变实验原理可以设计出更加简便的实验方案.请你用化学方程式来表示新方案的反应原理,并指出需要测定的数据:
化学方程式
| 高温 |
| 高温 |
需要测定的数据