网址:http://m.1010jiajiao.com/timu_id_6720[举报]
一、选择题
1.D 2.D 3.B 4.B 5.B 6.B 7.C 8.B 9.B 10.D 11.C 12.B 13.A 14.A 15.D 16.AC 17.B 18.C 19.D 20.C 21.D 22.C 23.C 24.C 25.C
二、填空题
1.2AgBr2Ag+Br2、2Ag+Br22AgBr、催化作用
2.生成的水煤气(CO或H2)燃烧,使得瞬时火焰更旺;相同;生成水煤气所吸收的热量和水煤气燃烧时增加的热量相同
3.(1)苏打 中和等量的H+,Na2CO3比NaHCO3的用量少(质量比为53∶84)
(2)小苏打 产生等量的CO2 NaHCO3比Na2CO3的用量少(质量比为84∶106)
(3)苏打 Na2CO3的水解程度比NaHCO3大,产生等量的OH-需Na2CO3的量较少
4.(1)Al2O3?2SiO2?2H2O
(2)SiO2+Na2SiO3Na2SiO3+CO2↑ Al2O3+Na2CO3=2NaAlO2+CO2↑
(3)H2SiO3 2H++SiO3=H2SiO3 Al3+水解生成Al(OH)3胶体,胶体吸附水中悬浮的杂质。
(4)铁坩埚。
5.(1)不移动 当压强增大2.5倍时,A物质的量浓度增大了2.5倍,说明平衡没有发生移动, 可知m+n=p (2)向左移动 当压强增大2倍时,A物质的量浓度却增加了2.2倍,说明平衡向生成A的方向移动 ①体积不变时,向容器内充入了A物质 ②增大压强体积变小时,B物质 转化成液态
6.(1)2 0.5
(2)若血液酸酸度增加,[H+]增大,H2CO3的电离平衡向逆反应方向移动,消耗H+ ,生成的H2CO3分解从肺部排出。
7.第①题实际上就是求如图的正四面体ABCD中,几何中心O与任意两顶点所成角之余弦。图 中,O′为O在底面上的投影。设边长为1,则CD=1,在底面三角形中,BC=1,故CE=,CO′=。在直角三角形AO′C中,AO′=。由于AO=CO=DO,设为x,则OO′=AO′-AO=,在直角三角形OO′C中,CO2=+,即x 2=,解得x=。 在Δ+DOC中,CO=DO=,CD=1,根据余弦定理解得 :co s∠COD=-(此角约为109°28′),即为金刚石中的键角的余弦值。
第②题中,0.2克拉=0.2×0.2克=0.04克(1克=5克拉)。此金刚石的“分子量”=×6.0×1023mol-1×12=2.4×1022。
说明:为此块金刚石中碳原子的物质的量,再乘以6.0×1 023为此金刚石中含有的碳原子个数。每个碳原子的原子量为12,故再乘以12为所有 碳原子的原子量之和,即为此金刚石的“分子量”。
③中的题目信息中的数值“五千以上”起到强烈的干扰作用。虽然②中算出的“分子量”远远大于五千,但金刚石是单质,不是化合物,故不能称其为高分子化合物。
三、论述和计算
1.(1)盐酸或稀硫酸。(2)在Ⅰ中开始产生H2后,将铜丝2在酒精灯上加热至红热,迅速伸入Ⅱ中。(3)Zn粒不断溶解,产生气泡;红热的铜丝由黑变成紫红色。(4)形成铜锌原电池,产生H2的速率快,实验完毕时可将铜丝向上提起,反应随即停止,类似于“启普发生 器”原理;铜丝2弯成螺旋状是为了提高铜丝局部的温度,以利于氧化铜在氢气中持续、快速被还原。(5)乙醇等。
2.由测定原理可知指示剂必为淀粉溶液。选用什么仪器向锥形瓶移橙汁呢?有部分同学填入了量筒,忽视了量筒是一种粗略的量器,精确度到不了百分位;也有部分同学填入了滴定管,若为碱式滴定滴,因维生素C溶液呈酸性,会腐蚀碱式滴定管的橡胶部位,故应填酸式滴定管或移液管。
解答实验过程(3)时,关键是第3空,必须搞清原理,是哪种溶液向哪种溶液中滴入,否则极 可能答反。正确的是:溶液蓝色不褪去,而不是蓝色褪去。
(五)是非常新颖的题型,它突出考查了学生实验后对数据利用的能力,测试时得分率极低,本题其实是书上实验数据处理的迁移,应取两次测定数据的平均值计算待测溶液的浓度,表 格如下:
滴定次数
待测液体积
标准碘体积
滴定前V
后V
实验V
平均值
1
2
然后列式计算可知含量为990mg/L。
(六)中问题讨论陷阱就更多了。(1)的答案几乎所有同学都这样答:防止溶液溅出,使测量有误差。但这是一个思维定势,因为溶液在锥形瓶中是不易溅出的。正确答案应根据“维生素C易被空气中的氧气氧化”,故答案为:不能,因为增大了与空气接触面,使之氧化。
(2)中显然不是天然橙汁,那么制造商可能采取什么做法?很多人选B。这是缺乏社会常识的选择,因为制造商毕竟要赚钱,选B必然亏本。这时再读题干,“在新鲜水果、蔬菜中都富含”说明维生素C价格低廉,所以选C。那么我们是否同意选C?因为制造商可能加入某种不是维生素C的还原剂,故应调查后再作结论。
3.(1)能有效利用的空气中含氧气
2.24×106×103×21%/22.4=2.1×107(mol)。
(2)因为=2%时,损伤人的智力,所以=210×。
(3)首先,该城市有效利用的空气允许一氧化碳的最大量是
n(CO)=。
其次,每辆汽车满负荷行驶每天排放出的一氧化碳的量是,所以每天允许满负荷行驶的汽车数为2×103/0.5=4×103(辆)。按平均每10 人有一辆汽车,该城市拥有4万辆汽车,则汽车的最大使用率为(4×103/4×104)×100% =10%。
4.(1)①臭氧;水;酸化 ②2O33O2;2H2O2H2↑+O2↑
(2)①浓厚的酸雾(H2SO4);白色沉淀。②空气中的SO2遇到矿尘或煤烟颗粒对SO2的固相催化作用就会形成酸雨。③60 t;36.7。 ④CaO+SO2=CaSO3,2CaSO3+O2=2 CaSO4;生石灰法。⑤见下图;⑥Na2SO3+SO3+SO2+H2O=2NaHSO3 2NaHSO3Na2SO3+SO2↑+H2O
5.(1)化学方程式①是正确的。这是因为:它表示了“金属泥”的生成;它体现了盐酸 是酸性介质,但并不实际上参加反应这一事实。
(c)COCl2+2NaOH2NaCl+CO2↑+H2O
(4)使烃分子减少不饱和度的反应是加成反应,消去反应则相反。
6.(1)乙醇中含有极性基团―OH,是极性分子,NaOH是离子化合物,据相似相溶原理,NaOH可溶于酒精溶液中。
(2)n(NaOH)= n(硬脂酸)==22.89mol
n(Cu(NO3)2)==2.66mol
中和硬脂酸需NaOH为22.89mol,剩下的2.11molNaOH与Cu(NO3)2反应消耗掉,故固体酒精碱性很低。
(3)固体酒精是由硬脂酸钠、NaNO3、Cu(NO3)2、Cu(OH)2和乙醇组成,点燃后有的燃烧,有的分解,所以残渣由CuO、Na、Na2CO3组成。
(4)加入硝酸铜的目的一是反应掉剩余的NaOH,二是生成的NaNO3和剩余的Cu(NO3)2在高温下具强氧化性,能充分氧化硬脂酸钠,使固体酒精燃烧充分。
(5)固体酒精的形成是因硬脂酸钠内部有无数小孔,形成了较大的表面积,吸附能力大大增 强,所以能像海绵一样吸住酒精。事先制的硬脂酸钠是实心块状的,难形成较多的微孔;在新制硬脂酸钠的过程中,加热保持微沸,有利于形成更多的微孔,能大大增强其负荷乙醇的能力。
7.(1)求1mol偏二甲肼分子中含C、H、N原子物质的量:
C:(60g×40%)÷12g?mol-1=2mol
H:(60g×13.33%)÷1g?mol-1=8mol
N:(60g×46.7%)×14g?mol-1=2mol
∴偏二甲肼的化学式为:C2H8N2
(2)依题意可写出发生反应的化学方程式并配平:C2H8N2+2N2O43N2+2CO2+4H2O
由上述方程式可知:C2H8N2中2个N-3原子被氧化成N2分子中N0原子,N2O4中4个N+4原子被还原到N2分子中NO原子,故该反应中被氧化的氮原子与被还原 氮原子物质的量之比为:2∶4=1∶2。
(3)红棕色气体在本题中为NO2特征颜色,结合题给条件应写出:N2O42NO2
8.(1)由考生比较熟悉的和的结构和性质的有关信息进行知识的迁移和类比。因N与P同为VA族元素,因此最高价氧化物对应的水化物的分子结构也应相似,由的结构式,可写出的结构式,其中三个N―O键为共价键,一个N→O键是配位键,在空间 为四面体结构。
(2)Na3NO4与水或CO2反应剧烈,怎样写出这个反应的化学方程式?由课本上所介绍
的在水溶液中很稳定,可推断出在水溶液中不稳定,易转化为离子,故可写出:
Na3NO4+H2O2NaOH+NaNO3
Na3NO4+CO2Na2CO3+NaNO3
(3)要推断NaNO4的结构,则必须突破结构的框框。显负一价,不可能具有NO那样的价键结构。由考生已有知识信息Na2O2或Na2S2O3受到启发:在根中是否有“―O―O―”过氧键结构,由此则可试写出的结构式:,因此写出NaNO4和水反应的化学方程式便是顺理成章的事情了。NaNO4+H2ONaNO3+H2O2,2H2O22H2O+O2↑,总反应化学方程式为: 2NaNO42NaNO3+O2↑
9.(1)C S
(2)Cl;K;Na;Ca
(3)Mg、O
(4)R:CaCl2;X:Ca(OH)2;Y:Ca(ClO)2;Z:HCl;C:HClO
10.“硫酸法”生产TiO2排出的废液中主要成分是H2SO4和Fe2+,如排 入水体将对水体导致如下3项污染效应:
(1)废液呈强酸性,会使接受废水的水体pH值明显减小。
(2)因废液中含Fe2+排入水体应发生如下反应:Fe2++2OH-Fe(O H)2↓,
4Fe(OH)2+2H2O+O24Fe(OH)3↓,消耗水体中OH-使水体pH 值减小。
(3)Mn2+、Zn2+、Cr3+、Cu2+等重金属离子排入水体造成对水体重金属污染,使水体生物绝迹。 可加废铁屑与废液中H2SO4反应以制备FeSO4?7H2O,消除酸对水体的污染。
11.(1)向血液中通入O2,血液变鲜红,再通CO2时变暗;(2)向血液中通CO,血液变鲜红 ,再通CO2或O2时颜色不变化。
12.解:(1)2NO+O2=2NO2 3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3 3O22O3
(2)①设生成NO的物质的量为x
NO - 180.74kJ
1 mol 180.74kJ
x
x=1.66×102mol
②由2NO ~ CO(NH)2 N原子守恒
∴CO(NH2)2的物质的量=×1.66×102 mol
CO(NH2)2的质量=×1.66mol×102×60g/mol=4.98×103g=4.98kg
14.由3Fe(OH)2+As2O3Fe3(AsO3)2+3H2O得出As2O3与碱 反应生成盐的事实可说明As2O3及其水化物显酸性
15.(1)构成石墨化纤维的元素有三种,即C、N、H,其原子个数之比依次为3∶1∶1。
(2)把丙烯腈分子中的C=C打开之后再加聚得???n。
16.(1)2Cl-CH2-COO??2e=Cl-CH2-CH2-Cl+2CO2↑? 2H++2e=H2?
(2)Cl-CH2-CH2-Cl+2KOHHO-CH2-CH2-OH+2KCl
HO-CH2-CH2-OH+O2
(3)
17.B、C两种物质在中学化学中没有介绍,但从对它们结构的分析中可以看出,B是一种环状酯,C是一种高分子酯,可模仿普通酯的合成反应来写这两个化学方程式。这两个反应分别为:
18.(1)C6H6O+7O2→6CO2+3H2 2C6H8O7+9O2→12CO2+8H2O C7H6O3+7O2→7CO2+3H2O
(2)化学需氧量为:
(3)1m3废水可产生的CO2为:(×6+×6+)=1.79mol
(10分)据报道,近来已制得了化合物A(白色晶体),它是用NaNO3和Na2O在银皿中于573K条件下反应7天后制得的。经分析,A中的阴离子与SO42-是等电子体,电导实验表明:A的电导与Na3PO4相同。
2-1 写出A的化学式并命名;写出A的阴离子的立体结构图并说明成键情况。
2-2 预测A的化学性质是否活泼?为什么?
2-3 实验表明:A对潮湿的CO2特别敏感,反应相当剧烈,试写出该反应化学方程式。
2-4 近年来,化学家已经制备了物质B。其中,组成A和B的元素完全相同,B的阴离子与A的阴离子表观形式相同(元素和原子个数均相同),但电导实验表明,其电导能力与NaCl相同。试写出B阴离子的结构式,并写出其与水反应的离子方程式。
查看习题详情和答案>>1996年诺贝尔化学奖授予对发现 ![]() 有重大贡献的三位科学家.
有重大贡献的三位科学家.![]() 分子是形如球状的多面体(如图2—20),该结构的建立基于以下考虑:
分子是形如球状的多面体(如图2—20),该结构的建立基于以下考虑:

①![]() 分子中每个碳原子只跟相邻的3个碳原子形成化学键;②
分子中每个碳原子只跟相邻的3个碳原子形成化学键;②![]() 分子只含有五边形和六边形;③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2.据上所述,可推知
分子只含有五边形和六边形;③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2.据上所述,可推知![]() 分子有12个五边形和20个六边形,
分子有12个五边形和20个六边形,![]() 分子所含的双键数为30.请回答下列问题:
分子所含的双键数为30.请回答下列问题:
(1)固体![]() 与金刚石相比较,熔点较高者应是___________,理由是_________.
与金刚石相比较,熔点较高者应是___________,理由是_________.
(2)试估计![]() 跟
跟![]() 在一定条件下能否发生反应生成
在一定条件下能否发生反应生成![]()
![]() (填“可能”或“不可能”)________.并简述其理由:_______.
(填“可能”或“不可能”)________.并简述其理由:_______.
(3)通过计算,确定![]() 分子所含单键数为________.
分子所含单键数为________.
(4)![]() 分子也已制得,它的分子结构模型可以与
分子也已制得,它的分子结构模型可以与![]() 同样考虑而推知,通过计算确定
同样考虑而推知,通过计算确定![]() 分子中五边形和六边形的数目.
分子中五边形和六边形的数目.![]() 分子中所含五边形数为__________,六边形数为________.
分子中所含五边形数为__________,六边形数为________.
(5)德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子,如图2-21所示.这一成果刊登在2000年9月7日出版的英国《自然》杂志上.根据理论计算,包含20个碳原子、仅仅由正五边形构成的![]() 分子是富勒式结构分子中最小的一种.
分子是富勒式结构分子中最小的一种.![]() 中有__________个五边形;共有______条棱边.
中有__________个五边形;共有______条棱边.

(6)目前,科学家拟合成一种“二重构造”的球型分子,即把“足球型”的![]() 与“足球型”的
与“足球型”的![]() 的分子进行重新构造,并使硅原子与碳原子以共价键结合.请回答下列问题:
的分子进行重新构造,并使硅原子与碳原子以共价键结合.请回答下列问题:
①你认为![]() 与
与![]() 的分子应采取怎样的镶嵌_________,理由是________.
的分子应采取怎样的镶嵌_________,理由是________.
②“二重构造”后的晶体属于_________晶体,其熔点与![]() 、
、![]() 相比_______.
相比_______.
(7)最近有人用一种称为“超酸”的化合物![]() 和
和![]() 反应,使
反应,使![]() 获得一个质子,得到一种新型离子化合物
获得一个质子,得到一种新型离子化合物![]() .回答如下问题:
.回答如下问题:
①以上反应类型上可以跟中学化学课本中的一个化学反应相比拟,后者是_______________________.
②上述阴离子![]() 的结构可以跟图2-22的硼二十面体相比拟,也是一个闭合的纳米笼,而且,
的结构可以跟图2-22的硼二十面体相比拟,也是一个闭合的纳米笼,而且,![]() 子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过.请在图2-23中添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子.
子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过.请在图2-23中添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子.


 1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家.C6O分子是形如球状的多面体(如图),该结构的建立基于以下考虑:
1996年诺贝化学奖授予对发现C60有重大贡献的三位科学家.C6O分子是形如球状的多面体(如图),该结构的建立基于以下考虑:①C6O分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C6O分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2
据上所述,可推知C6O分子有12个五边形和20个六边形,C6O分子所含的双键数为30.
请回答下列问题:
(1)固体C6O与金刚石相比较,熔点较高者应是
(2)试估计C6O跟F2在一定条件下,能否发生反应生成C6OF6O(填“可能”或“不可能”)
(3)通过计算,确定C6O分子所含单键数.C6O分子所含单键数为
(4)C7O分子也已制得,它的分子结构模型可以与C6O同样考虑而推知.通过计算确定C7O分子中五边形和六边形的数目:C7O分子中所含五边形数为

C60的结构
①C60分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②C60分子只含有五边形和六边形;
③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:
顶点数+面数-棱边数=2。
据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。
请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是_________,理由是:_____________________________________________________________________。
(2)试估计C60跟F2在一定条件下能否发生反应生成C60F60(填“可能”或“不可能”)_______________________,理由:__________________________________。
(3)通过计算,确定C60分子所含单键数为 _________________。
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中五边形和六边形的数目。C70分子中所含五边形数为___________,六边形数为__________。
查看习题详情和答案>>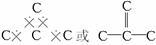
C60的结构
①C60分子中每个碳原子只跟相邻的3个原子形成化学键;②C60分子中只有五边形和六边形;③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2。据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是____________,理由是____________________。
(2)试估计C60与F2在一定条件下,能否发生反应生成C
(3)通过计算确定C60分子所含单键数。C60分子所含单键数为__________。
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中五边形和六边形数目。C70分子所含五边形数为__________,六边形数为__________。
查看习题详情和答案>>