网址:http://m.1010jiajiao.com/timu_id_6711[举报]
一、选择题
1.D 2.D 3.B 4.B 5.B 6.B 7.C 8.B 9.B 10.D 11.C 12.B 13.A 14.A 15.D 16.AC 17.B 18.C 19.D 20.C 21.D 22.C 23.C 24.C 25.C
二、填空题
1.2AgBr2Ag+Br2、2Ag+Br22AgBr、催化作用
2.生成的水煤气(CO或H2)燃烧,使得瞬时火焰更旺;相同;生成水煤气所吸收的热量和水煤气燃烧时增加的热量相同
3.(1)苏打 中和等量的H+,Na2CO3比NaHCO3的用量少(质量比为53∶84)
(2)小苏打 产生等量的CO2 NaHCO3比Na2CO3的用量少(质量比为84∶106)
(3)苏打 Na2CO3的水解程度比NaHCO3大,产生等量的OH-需Na2CO3的量较少
4.(1)Al2O3?2SiO2?2H2O
(2)SiO2+Na2SiO3Na2SiO3+CO2↑ Al2O3+Na2CO3=2NaAlO2+CO2↑
(3)H2SiO3 2H++SiO3=H2SiO3 Al3+水解生成Al(OH)3胶体,胶体吸附水中悬浮的杂质。
(4)铁坩埚。
5.(1)不移动 当压强增大2.5倍时,A物质的量浓度增大了2.5倍,说明平衡没有发生移动, 可知m+n=p (2)向左移动 当压强增大2倍时,A物质的量浓度却增加了2.2倍,说明平衡向生成A的方向移动 ①体积不变时,向容器内充入了A物质 ②增大压强体积变小时,B物质 转化成液态
6.(1)2 0.5
(2)若血液酸酸度增加,[H+]增大,H2CO3的电离平衡向逆反应方向移动,消耗H+ ,生成的H2CO3分解从肺部排出。
7.第①题实际上就是求如图的正四面体ABCD中,几何中心O与任意两顶点所成角之余弦。图 中,O′为O在底面上的投影。设边长为1,则CD=1,在底面三角形中,BC=1,故CE=,CO′=。在直角三角形AO′C中,AO′=。由于AO=CO=DO,设为x,则OO′=AO′-AO=,在直角三角形OO′C中,CO2=+,即x 2=,解得x=。 在Δ+DOC中,CO=DO=,CD=1,根据余弦定理解得 :co s∠COD=-(此角约为109°28′),即为金刚石中的键角的余弦值。
第②题中,0.2克拉=0.2×0.2克=0.04克(1克=5克拉)。此金刚石的“分子量”=×6.0×1023mol-1×12=2.4×1022。
说明:为此块金刚石中碳原子的物质的量,再乘以6.0×1 023为此金刚石中含有的碳原子个数。每个碳原子的原子量为12,故再乘以12为所有 碳原子的原子量之和,即为此金刚石的“分子量”。
③中的题目信息中的数值“五千以上”起到强烈的干扰作用。虽然②中算出的“分子量”远远大于五千,但金刚石是单质,不是化合物,故不能称其为高分子化合物。
三、论述和计算
1.(1)盐酸或稀硫酸。(2)在Ⅰ中开始产生H2后,将铜丝2在酒精灯上加热至红热,迅速伸入Ⅱ中。(3)Zn粒不断溶解,产生气泡;红热的铜丝由黑变成紫红色。(4)形成铜锌原电池,产生H2的速率快,实验完毕时可将铜丝向上提起,反应随即停止,类似于“启普发生 器”原理;铜丝2弯成螺旋状是为了提高铜丝局部的温度,以利于氧化铜在氢气中持续、快速被还原。(5)乙醇等。
2.由测定原理可知指示剂必为淀粉溶液。选用什么仪器向锥形瓶移橙汁呢?有部分同学填入了量筒,忽视了量筒是一种粗略的量器,精确度到不了百分位;也有部分同学填入了滴定管,若为碱式滴定滴,因维生素C溶液呈酸性,会腐蚀碱式滴定管的橡胶部位,故应填酸式滴定管或移液管。
解答实验过程(3)时,关键是第3空,必须搞清原理,是哪种溶液向哪种溶液中滴入,否则极 可能答反。正确的是:溶液蓝色不褪去,而不是蓝色褪去。
(五)是非常新颖的题型,它突出考查了学生实验后对数据利用的能力,测试时得分率极低,本题其实是书上实验数据处理的迁移,应取两次测定数据的平均值计算待测溶液的浓度,表 格如下:
滴定次数
待测液体积
标准碘体积
滴定前V
后V
实验V
平均值
1
2
然后列式计算可知含量为990mg/L。
(六)中问题讨论陷阱就更多了。(1)的答案几乎所有同学都这样答:防止溶液溅出,使测量有误差。但这是一个思维定势,因为溶液在锥形瓶中是不易溅出的。正确答案应根据“维生素C易被空气中的氧气氧化”,故答案为:不能,因为增大了与空气接触面,使之氧化。
(2)中显然不是天然橙汁,那么制造商可能采取什么做法?很多人选B。这是缺乏社会常识的选择,因为制造商毕竟要赚钱,选B必然亏本。这时再读题干,“在新鲜水果、蔬菜中都富含”说明维生素C价格低廉,所以选C。那么我们是否同意选C?因为制造商可能加入某种不是维生素C的还原剂,故应调查后再作结论。
3.(1)能有效利用的空气中含氧气
2.24×106×103×21%/22.4=2.1×107(mol)。
(2)因为=2%时,损伤人的智力,所以=210×。
(3)首先,该城市有效利用的空气允许一氧化碳的最大量是
n(CO)=。
其次,每辆汽车满负荷行驶每天排放出的一氧化碳的量是,所以每天允许满负荷行驶的汽车数为2×103/0.5=4×103(辆)。按平均每10 人有一辆汽车,该城市拥有4万辆汽车,则汽车的最大使用率为(4×103/4×104)×100% =10%。
4.(1)①臭氧;水;酸化 ②2O33O2;2H2O2H2↑+O2↑
(2)①浓厚的酸雾(H2SO4);白色沉淀。②空气中的SO2遇到矿尘或煤烟颗粒对SO2的固相催化作用就会形成酸雨。③60 t;36.7。 ④CaO+SO2=CaSO3,2CaSO3+O2=2 CaSO4;生石灰法。⑤见下图;⑥Na2SO3+SO3+SO2+H2O=2NaHSO3 2NaHSO3Na2SO3+SO2↑+H2O
5.(1)化学方程式①是正确的。这是因为:它表示了“金属泥”的生成;它体现了盐酸 是酸性介质,但并不实际上参加反应这一事实。
(c)COCl2+2NaOH2NaCl+CO2↑+H2O
(4)使烃分子减少不饱和度的反应是加成反应,消去反应则相反。
6.(1)乙醇中含有极性基团―OH,是极性分子,NaOH是离子化合物,据相似相溶原理,NaOH可溶于酒精溶液中。
(2)n(NaOH)= n(硬脂酸)==22.89mol
n(Cu(NO3)2)==2.66mol
中和硬脂酸需NaOH为22.89mol,剩下的2.11molNaOH与Cu(NO3)2反应消耗掉,故固体酒精碱性很低。
(3)固体酒精是由硬脂酸钠、NaNO3、Cu(NO3)2、Cu(OH)2和乙醇组成,点燃后有的燃烧,有的分解,所以残渣由CuO、Na、Na2CO3组成。
(4)加入硝酸铜的目的一是反应掉剩余的NaOH,二是生成的NaNO3和剩余的Cu(NO3)2在高温下具强氧化性,能充分氧化硬脂酸钠,使固体酒精燃烧充分。
(5)固体酒精的形成是因硬脂酸钠内部有无数小孔,形成了较大的表面积,吸附能力大大增 强,所以能像海绵一样吸住酒精。事先制的硬脂酸钠是实心块状的,难形成较多的微孔;在新制硬脂酸钠的过程中,加热保持微沸,有利于形成更多的微孔,能大大增强其负荷乙醇的能力。
7.(1)求1mol偏二甲肼分子中含C、H、N原子物质的量:
C:(60g×40%)÷12g?mol-1=2mol
H:(60g×13.33%)÷1g?mol-1=8mol
N:(60g×46.7%)×14g?mol-1=2mol
∴偏二甲肼的化学式为:C2H8N2
(2)依题意可写出发生反应的化学方程式并配平:C2H8N2+2N2O43N2+2CO2+4H2O
由上述方程式可知:C2H8N2中2个N-3原子被氧化成N2分子中N0原子,N2O4中4个N+4原子被还原到N2分子中NO原子,故该反应中被氧化的氮原子与被还原 氮原子物质的量之比为:2∶4=1∶2。
(3)红棕色气体在本题中为NO2特征颜色,结合题给条件应写出:N2O42NO2
8.(1)由考生比较熟悉的和的结构和性质的有关信息进行知识的迁移和类比。因N与P同为VA族元素,因此最高价氧化物对应的水化物的分子结构也应相似,由的结构式,可写出的结构式,其中三个N―O键为共价键,一个N→O键是配位键,在空间 为四面体结构。
(2)Na3NO4与水或CO2反应剧烈,怎样写出这个反应的化学方程式?由课本上所介绍
的在水溶液中很稳定,可推断出在水溶液中不稳定,易转化为离子,故可写出:
Na3NO4+H2O2NaOH+NaNO3
Na3NO4+CO2Na2CO3+NaNO3
(3)要推断NaNO4的结构,则必须突破结构的框框。显负一价,不可能具有NO那样的价键结构。由考生已有知识信息Na2O2或Na2S2O3受到启发:在根中是否有“―O―O―”过氧键结构,由此则可试写出的结构式:,因此写出NaNO4和水反应的化学方程式便是顺理成章的事情了。NaNO4+H2ONaNO3+H2O2,2H2O22H2O+O2↑,总反应化学方程式为: 2NaNO42NaNO3+O2↑
9.(1)C S
(2)Cl;K;Na;Ca
(3)Mg、O
(4)R:CaCl2;X:Ca(OH)2;Y:Ca(ClO)2;Z:HCl;C:HClO
10.“硫酸法”生产TiO2排出的废液中主要成分是H2SO4和Fe2+,如排 入水体将对水体导致如下3项污染效应:
(1)废液呈强酸性,会使接受废水的水体pH值明显减小。
(2)因废液中含Fe2+排入水体应发生如下反应:Fe2++2OH-Fe(O H)2↓,
4Fe(OH)2+2H2O+O24Fe(OH)3↓,消耗水体中OH-使水体pH 值减小。
(3)Mn2+、Zn2+、Cr3+、Cu2+等重金属离子排入水体造成对水体重金属污染,使水体生物绝迹。 可加废铁屑与废液中H2SO4反应以制备FeSO4?7H2O,消除酸对水体的污染。
11.(1)向血液中通入O2,血液变鲜红,再通CO2时变暗;(2)向血液中通CO,血液变鲜红 ,再通CO2或O2时颜色不变化。
12.解:(1)2NO+O2=2NO2 3NO2+H2O=2HNO3+NO或4NO2+O2+2H2O=4HNO3 3O22O3
(2)①设生成NO的物质的量为x
NO - 180.74kJ
1 mol 180.74kJ
x
x=1.66×102mol
②由2NO ~ CO(NH)2 N原子守恒
∴CO(NH2)2的物质的量=×1.66×102 mol
CO(NH2)2的质量=×1.66mol×102×60g/mol=4.98×103g=4.98kg
14.由3Fe(OH)2+As2O3Fe3(AsO3)2+3H2O得出As2O3与碱 反应生成盐的事实可说明As2O3及其水化物显酸性
15.(1)构成石墨化纤维的元素有三种,即C、N、H,其原子个数之比依次为3∶1∶1。
(2)把丙烯腈分子中的C=C打开之后再加聚得???n。
16.(1)2Cl-CH2-COO??2e=Cl-CH2-CH2-Cl+2CO2↑? 2H++2e=H2?
(2)Cl-CH2-CH2-Cl+2KOHHO-CH2-CH2-OH+2KCl
HO-CH2-CH2-OH+O2
(3)
17.B、C两种物质在中学化学中没有介绍,但从对它们结构的分析中可以看出,B是一种环状酯,C是一种高分子酯,可模仿普通酯的合成反应来写这两个化学方程式。这两个反应分别为:
18.(1)C6H6O+7O2→6CO2+3H2 2C6H8O7+9O2→12CO2+8H2O C7H6O3+7O2→7CO2+3H2O
(2)化学需氧量为:
(3)1m3废水可产生的CO2为:(×6+×6+)=1.79mol
维生素C的分子式是C6H8O6,水溶液呈酸性,高温或较长时间受热易损耗,许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素C,例如:新鲜橙汁中含维生素C浓度在500mg?L-1左右。
某校化学课外活动小组进行测定果汁中维生素C含量实验,下面是他们的实验过程及分析报告,请根据此报告填写有关空白。
(1)实验目的:测定××牌软包装鲜橙汁维生素C含量。
(2)实验原理:C6H8O6+I2→C6H6O6+2H++2I-。
(3)实验用品和试剂:
①仪器和用品(自选,略)
②试剂:浓度为7.50×10-3mol?L-1的标准碘(水)溶液,指示剂,蒸馏水等。
(4)实验过程:
①洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤的仪器有 。用标准液润洗的仪器是 。
②打开橙汁包,目测:颜色―橙黄色,澄清度―好,将仪器 该橙汁润洗2~3遍,移取20.00mL橙汁入锥形瓶,向瓶中加入2滴指示剂,该指示剂的名称是 。
③用左手操作滴定管,右手摇动锥形瓶,眼睛注视 。滴定至终点时的现象是 。
(5)数据记录和处理:(设计出表格,将三次滴定所得数据都填入表格中),若经数据处理,滴定中消耗标准碘溶液体积平均值为20.00mL,则此橙汁中维生素C的含量是 mg?L-1。
(6)问题讨论:
①从测定结果看,此软包装橙汁是否是纯天然橙汁 (填序号)
A、可能是 B、一定是 C、不是
②制造商可能采取的作法是 (填序号)
A、天然橙汁被加水稀释 B、天然橙汁被浓缩
C、向天然橙汁中添加维生素C D、用水和其原料混合制作
③对上述结论,你的意见是 (填序号)
A、向新闻界公布 B、向有关部门反映
C、继续实验 D、调查后再作结论
查看习题详情和答案>>维生素C对维持人体正常生理功能有重要作用,其分子式是C6H8O6 ,水溶液呈酸性,高温或较长时间受热易损耗。许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素
C,例如:新鲜橙果中的橙汁液中含维生素C浓度在500 mg·L-1左右。
某化学兴趣小组对标有“纯天然鲜橙原汁”的某市售橙汁中维生素C的含量进行了测定,请填写如下相关空白:
实验目的:测定市售××牌软包装纯天然鲜橙原汁饮料中维生素C的含量。
实验原理:C6H8O6 + I2 → C6H6O6 + 2 H+ + 2 I-。
实验用品和试剂:
部分可能用到的仪器如下:
![]()
![]()
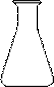
A B C
试剂:浓度为1.50×10-4mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
实验过程:
(1)洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤并需用标准液润洗的仪器有 (从上述A、B、C仪器中选择,填编号)。
(2)打开一袋橙汁包,目测:颜色——橙黄色,澄清度——好。准确量取20.00mL该汁液加入烧杯中溶解,并用100 mL (填仪器名称)定容配成100 mL稀橙汁。取洁净的 (从上述A、B、C仪器中选择,填编号),用上述稀橙汁润洗2~3次,并用该仪器取25.00mL稀橙汁入 中(从上述A、B、C仪器中选择,填编号),再加入约10mL蒸馏水充分摇匀,然后向其中加入2滴指示剂,应加指示剂的名称是 溶液。
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视 。滴定至终点时的现象是 。
(4)重复上述实验。
(5)数据记录和处理:
| 实验次数 | 稀橙汁体积(mL) | 滴定用标准碘(水)溶液(mL) |
| 1 | 25.00 | 23.10 |
| 2 | 25.00 | 23.00 |
| 3 | 25.00 | 22.90 |
从实验数据可知,该橙汁饮料中维生素C的含量为 mg·L-1
(6)假定该小组成员滴定终点时读数皆为俯视读数,则测定结果 (选填“偏高”或“偏低”或“无影响”)
查看习题详情和答案>>维生素C对维持人体正常生理功能有重要作用,其分子式是C6H8O6,水溶液呈酸性,高温或较长时间受热易损耗。许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素
C,例如:新鲜橙果中的橙汁液中含维生素C浓度在500 mg·L-1左右。
某化学兴趣小组对标有“纯天然鲜橙原汁”的某市售橙汁中维生素C的含量进行了测定,请填写如下相关空白:
实验目的:测定市售××牌软包装纯天然鲜橙原汁饮料中维生素C的含量。
实验原理:C6H8O6 + I2 →C6H6O6 + 2 H+ + 2 I-。
实验用品和试剂:
部分可能用到的仪器如下:
A B C
试剂:浓度为1.50×10-4mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
实验过程:
(1)洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤并需用标准液润洗的仪器有 (从上述A、B、C仪器中选择,填编号)。
(2)打开一袋橙汁包,目测:颜色——橙黄色,澄清度——好。准确量取20.00mL该汁液加入烧杯中溶解,并用100 mL (填仪器名称)定容配成100 mL稀橙汁。取洁净的 (从上述A、B、C仪器中选择,填编号),用上述稀橙汁润洗2~3次,并用该仪器取25.00mL稀橙汁入 中(从上述A、B、C仪器中选择,填编号),再加入约10mL蒸馏水充分摇匀,然后向其中加入2滴指示剂,应加指示剂的名称是 溶液。
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视 。滴定至终点时的现象是 。
(4)重复上述实验。
(5)数据记录和处理:
| 实验次数 | 稀橙汁体积(mL) | 滴定用标准碘(水)溶液(mL) |
| 1 | 25.00 | 23.10 |
| 2 | 25.00 | 23.00 |
| 3 | 25.00 | 22.90 |
从实验数据可知,该橙汁饮料中维生素C的含量为 mg·L-1
(6)假定该小组成员滴定终点时读数皆为俯视读数,则测定结果 (选填“偏高”或“偏低”或“无影响”)
查看习题详情和答案>>
维生素C对维持人体正常生理功能有重要作用,其分子式是C6H8O6 ,水溶液呈酸性,高温或较长时间受热易损耗。许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素
C,例如:新鲜橙果中的橙汁液中含维生素C浓度在500 mg·L-1左右。
某化学兴趣小组对标有“纯天然鲜橙原汁”的某市售橙汁中维生素C的含量进行了测定,请填写如下相关空白:
实验目的:测定市售××牌软包装纯天然鲜橙原汁饮料中维生素C的含量。
实验原理:C6H8O6 + I2 → C6H6O6 + 2 H+ + 2 I-。
实验用品和试剂:
部分可能用到的仪器如下: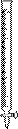
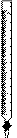
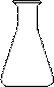
A B  C
C
试剂:浓度为1.50×10-4mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
实验过程:
(1)洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤并需用标准液润洗的仪器有 (从上述A、B、C仪器中选择,填编号)。
(2)打开一袋橙汁包,目测:颜色——橙黄色,澄清度——好。准确量取20.00mL该汁液加入烧杯中溶解,并用100 mL (填仪器名称)定容配成100 mL稀橙汁。取洁净的 (从上述A、B、C仪器中选择,填编号),用上述稀橙汁润洗2~3次,并用该仪器取25.00mL稀橙汁入 中(从上述A、B、C仪器中选择,填编号),再加入约10mL蒸馏水充分摇匀,然后向其中加入2滴指示剂,应加指示剂的名称是 溶液。
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视 。滴定至终点时的现象是  。
。
(4)重复上述实验。
(5)数据记录和处理:
| 实验次数 | 稀橙汁体积(mL) | 滴定用标准碘(水)溶液(mL) |
| 1 | 25.00 | 23.10 |
| 2 | 25.00 | 23.00 |
| 3 | 25.00 | 22.90 |
(6)假定该小组成员滴定终点时读数皆为俯视读数,则测定结果 (选填“偏高”或“偏低”或“无影响”) 查看习题详情和答案>>
维生素C对维持人体正常生理功能有重要作用,其分子式是C6H8O6 ,水溶液呈酸性,高温或较长时间受热易损耗。许多新鲜水果、蔬菜、乳制品中都含有丰富的维生素
C,例如:新鲜橙果中的橙汁液中含维生素C浓度在500 mg·L-1左右。
某化学兴趣小组对标有“纯天然鲜橙原汁”的某市售橙汁中维生素C的含量进行了测定,请填写如下相关空白:
实验目的:测定市售××牌软包装纯天然鲜橙原汁饮料中维生素C的含量。
实验原理:C6H8O6 + I2 → C6H6O6 + 2 H+ + 2 I-。
实验用品和试剂:
部分可能用到的仪器如下:



A B C
试剂:浓度为1.50×10-4mol·L-1的标准碘(水)溶液,指示剂,蒸馏水等。
实验过程:
(1)洗涤仪器,检查是否漏液,用标准液润洗后装好标准液待用。在此步操作中,需用蒸馏水洗涤并需用标准液润洗的仪器有 (从上述A、B、C仪器中选择,填编号)。
(2)打开一袋橙汁包,目测:颜色——橙黄色,澄清度——好。准确量取20.00mL该汁液加入烧杯中溶解,并用100 mL (填仪器名称)定容配成100 mL稀橙汁。取洁净的 (从上述A、B、C仪器中选择,填编号),用上述稀橙汁润洗2~3次,并用该仪器取25.00mL稀橙汁入 中(从上述A、B、C仪器中选择,填编号),再加入约10mL蒸馏水充分摇匀,然后向其中加入2滴指示剂,应加指示剂的名称是 溶液。
(3)用左手操作滴定管,右手摇动锥形瓶,眼睛注视 。滴定至终点时的现象是 。
(4)重复上述实验。
(5)数据记录和处理:
|
实验次数 |
稀橙汁体积(mL) |
滴定用标准碘(水)溶液(mL) |
|
1 |
25.00 |
23.10 |
|
2 |
25.00 |
23.00 |
|
3 |
25.00 |
22.90 |
从实验数据可知,该橙汁饮料中维生素C的含量为 mg·L-1
(6)假定该小组成员滴定终点时读数皆为俯视读数,则测定结果 (选填“偏高”或“偏低”或“无影响”)
查看习题详情和答案>>