摘要:(3)在一定条件下.将44.8L 和67.2L H(气体体积已换算为标准状况下的体积)混合.使之反应合成.反应达到平衡时.测得混合气体中的体积分数为25%.则平衡时混合气体在标准状况下的大体是 .
网址:http://m.1010jiajiao.com/timu_id_66694[举报]
一、选择题
6.D 7.A 8.D 9.D 10.A 11.B 12.D 13.B
(化学部分).files/image148.jpg) 26.(16分)(1)
26.(16分)(1)(化学部分).files/image150.gif) (2)
(2)(化学部分).files/image152.gif) 极性、非极性、直线型
极性、非极性、直线型
(化学部分).files/image148.jpg) (3)
(3)(化学部分).files/image154.gif) (4)
(4)(化学部分).files/image156.gif) ,(5)
,(5)(化学部分).files/image158.gif)
(化学部分).files/image148.jpg) 27.(18分)
(1)①
27.(18分)
(1)①(化学部分).files/image160.gif)
(化学部分).files/image148.jpg) ②碱石灰(或
②碱石灰(或(化学部分).files/image162.gif) 或生石灰)
或生石灰)
(化学部分).files/image148.jpg) ③极易溶于水,水溶液呈碱性 ④B
③极易溶于水,水溶液呈碱性 ④B
(化学部分).files/image148.jpg) (2)让空气通过灼热的铜网 ①混合
(2)让空气通过灼热的铜网 ①混合(化学部分).files/image164.gif) 并使其干燥 ②观察导气管口气泡数量,调查气体流量,使
并使其干燥 ②观察导气管口气泡数量,调查气体流量,使(化学部分).files/image166.gif) 达最佳混合比1:3 将湿润的红色石蕊试纸靠近出气管口,试纸变量,说明气体为
达最佳混合比1:3 将湿润的红色石蕊试纸靠近出气管口,试纸变量,说明气体为(化学部分).files/image115.gif) (其他合理答案同样给分)
(其他合理答案同样给分)
(3)89.6L
28.(12分) (1)(化学部分).files/image169.gif)
(化学部分).files/image170.jpg)
(2)加成反应 强见的醇溶液、加热(化学部分).files/image171.jpg)
(化学部分).files/image173.jpg)
“生物质“是指由植物或动物生命体衍生得到的物质的总称.“生物质能”是人类解决能源危机的一种重要的能源.“生物质”在一定条件下可气化为CO、H2等原料气,进而合成甲醇和二甲醚(CH3OCH3),相关反应为:①2H2(g)+CO(g)?CH3OH(g) ②4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)
请根据图1所示回答问题: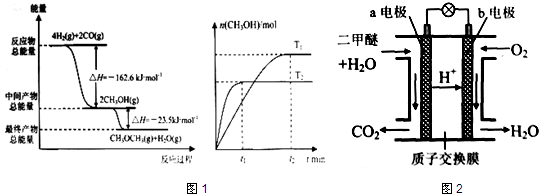
(1)由H2和CO合成二甲醚的热化学方程式是 .
(2)在T1、T2温度下,向两个容积相同的密闭容器中分别通入1molCO和2molH2合成甲醇,则T1、T2温度下对应反应的平衡常数K1 K2 (选填“<”、“>”或“=”).
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3(g)和1molH20(g),经一定时间反应②达到平衡状态,此时测得混合气体的密度是起始时的1.6倍.反应开始时正、逆反应速率的大小关系为V(正) V(逆)(选填“>”、“<”或“=”),平衡时n(CH3OCH3)= mol.
(4)如图2为绿色电源“二甲醚燃料电池”的工作原理示意图.(a、b均为多孔性Pt电极)b电极是 极.(填“正”或“负”)
a电极上的电极反应为 .
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol?L-1CaCl2溶液与2.00×10-2mol?L-1Na2S04溶液等体积混合(忽略体积的变化>,则生成沉淀时,c的最小值是 .
查看习题详情和答案>>
请根据图1所示回答问题:

(1)由H2和CO合成二甲醚的热化学方程式是
(2)在T1、T2温度下,向两个容积相同的密闭容器中分别通入1molCO和2molH2合成甲醇,则T1、T2温度下对应反应的平衡常数K1
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3(g)和1molH20(g),经一定时间反应②达到平衡状态,此时测得混合气体的密度是起始时的1.6倍.反应开始时正、逆反应速率的大小关系为V(正)
(4)如图2为绿色电源“二甲醚燃料电池”的工作原理示意图.(a、b均为多孔性Pt电极)b电极是
a电极上的电极反应为
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol?L-1CaCl2溶液与2.00×10-2mol?L-1Na2S04溶液等体积混合(忽略体积的变化>,则生成沉淀时,c的最小值是
下列八种晶体:
A、铝 B、金刚石 C、氧化镁 D、冰醋酸 E、氩晶体 F、硫酸铵 G、水晶 H、白磷
(1)属于原子晶体的化合物是
(2)含有共价键的离子晶体是
(3)在一定条件下,能导电而不发生化学变化的是
查看习题详情和答案>>
A、铝 B、金刚石 C、氧化镁 D、冰醋酸 E、氩晶体 F、硫酸铵 G、水晶 H、白磷
(1)属于原子晶体的化合物是
G
G
,直接由原子构成的分子晶体是E
E
.(2)含有共价键的离子晶体是
F
F
,属于分子晶体的单质是EH
EH
.(3)在一定条件下,能导电而不发生化学变化的是
A
A
,受热熔化需克服共价键的是BG
BG
.现有A、B、C、D、E、F六种短周期元素,原子序数依次增大.已知A与D、C与E分别同主族,D、E、F同周期;A、B的最外层电子数之和与C的最外层电子数相等,A与C形成的化合物常温下均为液态,A分别与E、F形成的气体分子电子总数相等.
请回答下列问题:
(1)元素B在周期表中的位置是
 .
.
(2)A2C比A2E沸点高的原因是
(3)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池正极的电极反应式为
(4)化合物B2A4和B2C4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染.1mol B2A4与B2C4完全反应生成两种气体时放出热量516.8kJ,则该反应的热化学方程式为
查看习题详情和答案>>
请回答下列问题:
(1)元素B在周期表中的位置是
第二周期第ⅤA族
第二周期第ⅤA族
,元素D的原子结构示意图为

(2)A2C比A2E沸点高的原因是
H2O分子间存在氢键而H2S分子间不能形成氢键
H2O分子间存在氢键而H2S分子间不能形成氢键
.(3)在一定条件下,A、C的单质和A、C、D形成的离子化合物的水溶液可构成电池,该电池正极的电极反应式为
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
,负极的电极反应式为2H2+4OH--4e-═4H2O
2H2+4OH--4e-═4H2O
,该电池在放电过程中,电解质溶液的pH将减小
减小
(填“增大”、“减小”或“不变”).(4)化合物B2A4和B2C4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染.1mol B2A4与B2C4完全反应生成两种气体时放出热量516.8kJ,则该反应的热化学方程式为
2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H=-1033.6kJ?mol-1
2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H=-1033.6kJ?mol-1
.有机物A有关的转化关系如图,已知,E为高分子化合物,化合物F中只有两种类型氢,G为五元环状化合物.
请回答下列问题:
(1)化合物A含有的官能团是
(2)1mol A与2mol H2反应生成1mol D,其反应的化学方程式是
(3)在一定条件下,A转化为E的化学方程式是
 .
.
(4)与A具有相同官能团的A的同分异构体的结构简式是
 .
.
(5)B在酸性条件下与Br2反应得到F,F的结构简式是
(6)G的结构简式是
 .由D生成G的反应类型是
.由D生成G的反应类型是
查看习题详情和答案>>

请回答下列问题:
(1)化合物A含有的官能团是
碳碳双键、醛基、羧基
碳碳双键、醛基、羧基
.(2)1mol A与2mol H2反应生成1mol D,其反应的化学方程式是
OHC-CH=CH-COOH+2H2
HOCH2CH2CH2COOH
| Ni |
| △ |
OHC-CH=CH-COOH+2H2
HOCH2CH2CH2COOH
.| Ni |
| △ |
(3)在一定条件下,A转化为E的化学方程式是


(4)与A具有相同官能团的A的同分异构体的结构简式是


(5)B在酸性条件下与Br2反应得到F,F的结构简式是
HOOCCHBrCHBrCOOH
HOOCCHBrCHBrCOOH
.(6)G的结构简式是


酯化
酯化
.(2010?青岛二模)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2=
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2
2NH3,则在电化学合成氨的过程中,阴极反应式为
(3)在一定条件下,将l mol N2与3mol H2混合于一个10L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,
试回答:①N2的转化率为
②右图中在状态A时,平衡常数 KA
(填写代入数值的表达式,不要求算出具体数值);当温度由T1变化到T2时,KA
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
反应从0min到3min之间,H2的反应速率为
a.使用催化剂 b.降低温度 c.增加H2的浓度.
查看习题详情和答案>>
(1)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2=
-1160kJ?mol-1
-1160kJ?mol-1
;(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2
| ||
| 一定条件 |
N2+6H++6e-=2NH3
N2+6H++6e-=2NH3
;(3)在一定条件下,将l mol N2与3mol H2混合于一个10L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,
试回答:①N2的转化率为
40%
40%
;
②右图中在状态A时,平衡常数 KA
| 0.082 |
| 0.06×0.183 |
| 0.082 |
| 0.06×0.183 |
>
>
KB(填“>”、“<”或“=”).③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 时间/min 浓度/mol.L |
c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
0.08mol?L-1?min-1
0.08mol?L-1?min-1
;反应在3min时,条件发生了改变,改变的条件可能是a
a
(填序号).a.使用催化剂 b.降低温度 c.增加H2的浓度.