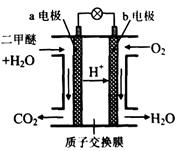
题目内容
“生物质“是指由植物或动物生命体衍生得到的物质的总称.“生物质能”是人类解决能源危机的一种重要的能源.“生物质”在一定条件下可气化为CO、H2等原料气,进而合成甲醇和二甲醚(CH3OCH3),相关反应为:①2H2(g)+CO(g)?CH3OH(g) ②4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g)
请根据图1所示回答问题: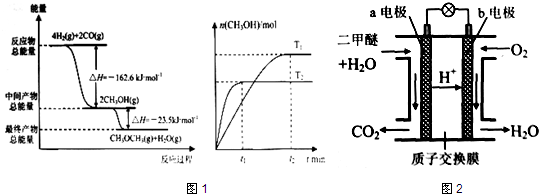
(1)由H2和CO合成二甲醚的热化学方程式是 .
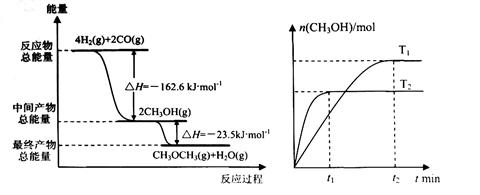
(2)在T1、T2温度下,向两个容积相同的密闭容器中分别通入1molCO和2molH2合成甲醇,则T1、T2温度下对应反应的平衡常数K1 K2 (选填“<”、“>”或“=”).
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3(g)和1molH20(g),经一定时间反应②达到平衡状态,此时测得混合气体的密度是起始时的1.6倍.反应开始时正、逆反应速率的大小关系为V(正) V(逆)(选填“>”、“<”或“=”),平衡时n(CH3OCH3)= mol.
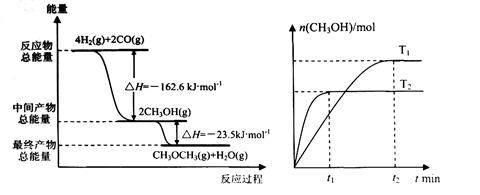
(4)如图2为绿色电源“二甲醚燃料电池”的工作原理示意图.(a、b均为多孔性Pt电极)b电极是 极.(填“正”或“负”)
a电极上的电极反应为 .
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol?L-1CaCl2溶液与2.00×10-2mol?L-1Na2S04溶液等体积混合(忽略体积的变化>,则生成沉淀时,c的最小值是 .
请根据图1所示回答问题:

(1)由H2和CO合成二甲醚的热化学方程式是
(2)在T1、T2温度下,向两个容积相同的密闭容器中分别通入1molCO和2molH2合成甲醇,则T1、T2温度下对应反应的平衡常数K1
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3(g)和1molH20(g),经一定时间反应②达到平衡状态,此时测得混合气体的密度是起始时的1.6倍.反应开始时正、逆反应速率的大小关系为V(正)
(4)如图2为绿色电源“二甲醚燃料电池”的工作原理示意图.(a、b均为多孔性Pt电极)b电极是
a电极上的电极反应为
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10-6.现将c mol?L-1CaCl2溶液与2.00×10-2mol?L-1Na2S04溶液等体积混合(忽略体积的变化>,则生成沉淀时,c的最小值是
分析:(1)依据图象分析书写热化学方程式,根据盖斯定律计算所需热化学方程式;
(2)图象分析,先拐先平的分析方法可知T1<T2,依据化学平衡移动原理分析判断;
(3)反应前后气体总质量不变;用差量法解题,方程式中3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)减少了4mol;
(4)氧气得电子,化合价降低,故b电极是正极;由图知在a电极二甲醚与水反应生成二氧化碳和氢离子,故a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+;
(5)依据溶度积常数计算离子浓度.
(2)图象分析,先拐先平的分析方法可知T1<T2,依据化学平衡移动原理分析判断;
(3)反应前后气体总质量不变;用差量法解题,方程式中3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)减少了4mol;
(4)氧气得电子,化合价降低,故b电极是正极;由图知在a电极二甲醚与水反应生成二氧化碳和氢离子,故a电极的反应式为(CH3)2O-12e-+3H2O=2CO2+12H+;
(5)依据溶度积常数计算离子浓度.
解答:解:(1)图象分析可知反应的热化学方程式为 ①4H2(g)+2CO(g)=2CH3OH(g);△H=-162.6kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ?mol-1
由盖斯定律①+②得到:4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g)△H=-186.1KJ/mol,
故答案为:4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g)△H=-186.1KJ/mol;
(2)图象分析可知T1<T2,温度越高甲醇物质的量越小,说明升温平衡逆向进行,正反应为放热反应,2H2(g)+CO(g)?CH3OH(g),则T1、T2温度下对应反应的平衡常数K1>K2,故答案为:>;
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3(g)和1molH20(g),4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小,平衡正向进行;平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的0.625倍,总物质的量=8×0.625=5mol,反应前后减少了3mol,设反应生成甲醚xmol,
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)减少了4mol,
1 4
x 3
解得:x=0.75mol
平衡时,n(CH3OCH3)=1+0.75=1.75mol,
故答案为:平衡正移;1.75;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,氧气在正极放电,b电极为正极,由图可知,a极为负极,二甲醚放电生成二氧化碳,由离子交换膜可知还生成氢离子,a电极的电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+,故答案为:正;CH3OCH3+3H2O-12e-=2CO2+12H+;
(5)cmol?L-1CaCl2溶液中加入2.00×10-2mol?L-1Na2S04溶液等体积混合,硫酸钠溶液的浓度变为1×10-2mol/L,根据溶度积常数计算,c(Ca2+)=
=
=9.1×10-4mol/L,因为是等体积混合,所以混合前溶液的浓度是混合后的2倍,所以混合前钙离子溶液的浓度为9.1×10-4mol/L×2=1.82×10-3mol/L,
故答案为:1.82×10-3mol/L.
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ?mol-1
由盖斯定律①+②得到:4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g)△H=-186.1KJ/mol,
故答案为:4H2(g)+2CO(g)=CH3OCH3(g)+H2O(g)△H=-186.1KJ/mol;
(2)图象分析可知T1<T2,温度越高甲醇物质的量越小,说明升温平衡逆向进行,正反应为放热反应,2H2(g)+CO(g)?CH3OH(g),则T1、T2温度下对应反应的平衡常数K1>K2,故答案为:>;
(3)在一定条件下,向一个容积可变的密闭容器中充入4molH2、2molCO、1molCH3OCH3(g)和1molH20(g),4H2(g)+2CO(g)?CH3OCH3(g)+H2O(g),反应前后气体总质量不变,同温、同压下,达到平衡时,气体密度增大,即气体体积缩小,平衡正向进行;平衡时混合气体密度是同温同压下起始时的1.6倍,则总物质的量变为原先的0.625倍,总物质的量=8×0.625=5mol,反应前后减少了3mol,设反应生成甲醚xmol,
3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)减少了4mol,
1 4
x 3
解得:x=0.75mol
平衡时,n(CH3OCH3)=1+0.75=1.75mol,
故答案为:平衡正移;1.75;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,氧气在正极放电,b电极为正极,由图可知,a极为负极,二甲醚放电生成二氧化碳,由离子交换膜可知还生成氢离子,a电极的电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+,故答案为:正;CH3OCH3+3H2O-12e-=2CO2+12H+;
(5)cmol?L-1CaCl2溶液中加入2.00×10-2mol?L-1Na2S04溶液等体积混合,硫酸钠溶液的浓度变为1×10-2mol/L,根据溶度积常数计算,c(Ca2+)=
| Ksp |
| C(SO42-) |
| 9.10×10-6 |
| 1×10-2 |
故答案为:1.82×10-3mol/L.
点评:本题考查影响平衡的因素、化学平衡常数、化学平衡图象、反应热的计算原电池原理应用等,注意沉淀溶解平衡的分析计算,难度中等.

练习册系列答案
相关题目
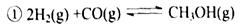

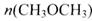 =_________mol。
=_________mol。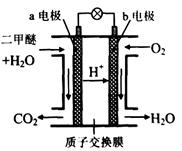
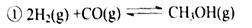

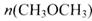 =_________mol。
=_________mol。