网址:http://m.1010jiajiao.com/timu_id_6659[举报]
(一)选择题
1.C 2.A、C 3.D 4.C 5.B、D 6.A 7.C 8.A、D 9.C 10.B 11.A
(二)非选择题
1.(1)过滤;蒸发 (2)B (3)滤液浑浊 (4)液体飞溅 (5)K2CO3,KCl,K2SO4
2.(1)先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却 (2)将反应容器 放在50~60℃的水浴中加热 (3)分液漏斗 (4)除去粗产品中的残留酸 (5)大,苦杏仁
3.(1)除去吸入空气中的CO2 (2)D (3)可增大气体与溶液的接触面,使气体中的CO2被充分吸收;
(4)
(5)把瓶Ⅰ中的NaOH溶液吸入口中;把瓶Ⅱ中的NaOH溶液吹出瓶外
4.(1)增加一种反应物,有利于酯化反应向正反方向进行 (2)蒸出生成物,有利于酯化 反应向正反应方向进行 (3)B (4)除去粗产品中的乙醇 (5)除去粗产品中的水
5.(1)①适当稀释浓H2SO4,防止HBr被氧化 ②吸收溶解的HBr。
(2)②控制恒温,38.4℃。该温度下只有溴乙烷蒸馏出来。
(3)②使沸点高于溴乙烷的副产品回流。
(4)及时分馏出产物,促使平衡正向移动。
(5)密度比水大且难溶于水,水封,防止蒸气逸出,并防止倒吸,E。
6.(1)Ⅱ (2)F,G,E,H 吸收空气中的水蒸气和CO2 (3)F,C (4)A,B,C,F
(5)C2H5OH+CuOCH3CHO+Cu+H2O 乙醛,乙醇 (6)E,G 不合理
7.(1)b,c,a,c,d 吸收未反应的氨,防止空气水分进入 ② 固体由黑色变为红色;③a,c (2)a,c
8.(1)A,B,D,F,G,H,J 坩锅 泥三角 药匙 (2)(W2-W3)/(W2-W1)×100% 偏高 A,D
9.(1)使Fe2+氧化成易于分离的Fe3+
(2)A (3)CuO,Fe(OH)3和过量的CuO
(4)A,B,D,G,I
10.(1)是由于氯水中氢离子与碱中和 (2)是氯水中次氯酸氧化所致。
11.(1)过滤,萃取,Cl2+2I-=I2+2Cl-
(2)B (3)分液漏斗
(4)①缺石棉网 ②温度计插到了液体中 ③冷凝管进出水的方向颠倒
(5)使蒸馏烧瓶受热均匀,控制温度,以防止碘在局部高温时升华。蒸馏烧瓶
12.(1)32g/mol N2H4 (2)N2H4+2CuO2Cu+N2+2H2O
13.(1)把导管b的下端浸于水中,用手握紧试管a,导管会有气泡冒出;松开后,水又会回升到导管b中。 (2)3Cu+8HNO33Cu(NO3)2+2NO↑+4H2O 2NO+O2=2NO2
(3)①铜片上有无色气泡产生,反应速率开始缓慢,后逐渐加快;②试管上部空间由无色变为浅棕色,又变成无色;③试管a中的溶液由无色变为浅蓝色;④反应结束时,铜片全部溶解。(4)由于反应开始时产生的NO和试管a上部空气中的O2作用生成NO2,N O2易溶于水并与水反应,使度管a内气体压强暂时减小,所以导管中的水面会上升到一定 高度
(5)①水进入试管,上升到一定高度;②试管中气体的颜色由棕色变为无色。
14.(1)红棕色 (2)溴与AgNO3反应生成AgBr沉淀,无法确定溴与苯反应有HBr生成
(3 )①吸收烧瓶中的溴蒸气,减少对环境污染 ②与混合液中残余的溴反应,以利于溴苯的提纯 、分离
15.(1)B (2)把该仪器放入冰水里,玻璃管内混合气体颜色变浅;或把该仪器放入热水里, 玻璃管内混合气体颜色变深
16.(1)①c ②a ③检查装置的气密性 本反应为放热反应 ④将系统内的空气排尽 c
(2)①干燥气体 ②使两种气体充分混合 ③观察气泡以调节氢、氮气流速度
NH3及N2、H2的混合物 用蘸有浓盐酸的玻璃棒放在导管口,有白烟说明有氨生成
17.①A,B ②[K+]≥0.2mol/L []=0.1mol/L [] =0.2mol/L
[]=0.4mol/L
18.(1)NaOH、BaCl2、Na2CO3、HCl
(2)2NaCl+2H2O2NaOH+2H2+2Cl2?
(3)干燥的HCl,防止MgCl2?6H2O受热脱水时水解。
aE,C, NaCl+H2SO4(浓) NaHSO4+HCl?
bL⑤、①、②、③、⑦、④、③
cM浓H2S4,稀NaOH,NaCl(s),MgCl2?6H2O,浓H2SO4
d吸收HCl气体,白色酸雾。
19.(1)SOCl2+H2O2HCl+SO2↑
(2)由SOCl2与水反应“剧烈”,可知SOCl2与晶体ZnCl2?3H2O混合共热时,SOCl2就优先于Zn2+与水结合,生成HCl,因而从两个方面抑制ZnCl2水解:
ZnCl2+H2OZn(OH)Cl+HCl,得到无水ZnCl2。
(3)C2H5OH+SOCl2C2H5Cl+SO2↑+HCl↑
(4)由题给信息可知SOCl2的沸点仅为77℃,较低,所以可用蒸馏的方法除去。故选D。
(16分)某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,因温度不同、受热不均时会生成Fe3O4且也能被磁铁吸引。为探究X的组成,他们进行了如下实验。
Ⅰ.定性检验
|
实验编号 |
实 验 操 作 |
实 验 现 象 |
|
① |
取少量黑色粉末X放入试管1中,注入适量稀盐酸,微热。 |
黑色粉末逐渐溶解,有无色气体逸出。 |
|
② |
向试管1所得溶液中滴加几滴 KSCN溶液,振荡。 |
溶液未出现血红色 |
(1)由上述实验现象推断,黑色粉末X的成分中是否一定不含Fe3O4?____(填“是”或“否”)。
(2)实验①中可能发生反应的离子方程是 , , 。
Ⅱ.定量测定

(3)操作Z是 。在灼烧沉淀时必须用到的下列仪器的名称是____________________________。

(4)通过以上数据,得出3.44g黑色粉末X中各成分的物质的量为:______、______。
查看习题详情和答案>>
(16分)某研究性学习小组在用CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,因温度不同、受热不均时会生成Fe3O4且也能被磁铁吸引。为探究X的组成,他们进行了如下实验。
Ⅰ.定性检验
| 实验编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入适量稀盐酸,微热。 | 黑色粉末逐渐溶解,有无色气体逸出。 |
| ② | 向试管1所得溶液中滴加几滴 KSCN溶液,振荡。 | 溶液未出现血红色 |
(2)实验①中可能发生反应的离子方程是 , , 。
Ⅱ.定量测定

(3)操作Z是 。在灼烧沉淀时必须用到的下列仪器的名称是____________________________。

(4)通过以上数据,得出3.44g黑色粉末X中各成分的物质的量为:______、______。 查看习题详情和答案>>
(12分)铁不能与冷、热水反应,但能与水蒸气反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 0C 时,生成FeO,高于570 0C时,生成Fe3O4。老师用上图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
![]() (1)实验中使用肥皂液的作用是 。
(1)实验中使用肥皂液的作用是 。
![]() (2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,能确定固体中存在的物质是 ;不能确定是否存在Fe3O4的原因是 。
![]() (3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4:
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4:
![]() ①溶液X中发生氧化还原反应的离子方程式为 。
①溶液X中发生氧化还原反应的离子方程式为 。

②操作a包括过滤和洗涤,检验沉淀是否已经洗涤干净的操作是 。
③确定是否存在Fe3O4需要测定并记录的实验数据是 。
查看习题详情和答案>>
(1)提出问题,实验一中的CO2能灭火,而实验二中的CO2为何能“点火”?
(2)对实验二提出的解释:
CO2被Na2O2吸收.可能生成Na2CO3;棉花被点燃,说明上述反应
(3)现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水).

请填写下列空白:
(1)写出实验中Na2O2发生反应的化学方程式:
(2)应选用的装置是
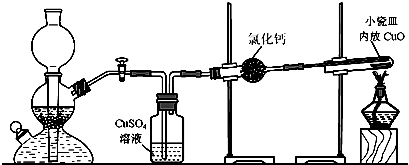
(1)在启普发生器中纯锌与稀硫酸反应过于缓慢,可采取的加快速率的措施是①适当增大硫酸的浓度,②
(2)用纯度不高的锌(粗锌)制取氢气,反应速率快,但制得的氢气因含H2S等还原性杂质而有难闻的气味,CuSO4洗气瓶中观察到的现象是
(3)有同学发现粗锌与稀硫酸反应一段时间后,锌粒表面变黑,于是收集了少量该黑色固体,验证黑色固体含铁元素的简单化学方法
(4)实验中得到的数据有:小瓷皿的质量mg,小瓷皿加样品的质量n g,反应后小瓷皿加固体的质量w g,已知氧的相对原子质量为16,则铜的相对原子质量是
| 16(w-m) |
| n-w |
| 16(w-m) |
| n-w |
(5)某次实验中测定结果明显偏大,可能的原因是
a.未充分冷却即停止通氢气 b.氧化铜样品中含有氯化铵杂质
c.反应后固体中有少量Cu2O d.氢气不干燥有少量水分
(6)由于启普发生器药品用量较多,利用下列仪器装配一套有启普发生器功能的简易装置,你选择