摘要:29. A.B.C.D是四种短周期元素.它们的原子序数依次增大.其中.A.C及B.D分别是同主族元素,A元素的原子半径是所有主族元素中原子半径最小的,B.D两元素的原子核中质子数之和是A.C两元素原子核中质子数之和的2倍,四种元素所形成的单质中A.B单质是气体.C.D单质是固体.(1)写出以下元素的名称: B ,C .(2)用电子式表示C2D的形成过程: .(3)由B.C两元素所形成的原子个数比为1┱1的化合物属于 化合物.存在的化学键的种类有 .写出它与水反应的离子方程式 .(4)实验室常用A.B两元素所形成的原子个数为1┱1的化合物来制备一种常见气体.其化学方程式为 .此实验中常加入一种黑色粉未物质.其作用是 .
网址:http://m.1010jiajiao.com/timu_id_63311[举报]
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别位于同一主族,A是自然界中原子半径最小的元素,B的最外层电子数是内层电子数的3倍.
(1)写出B的元素符号:B
 ;
;
(2)B与D的氢化物较稳定的是
(3)写出C2B2的电子式
 ;写出实验室制取DB2的化学方程式:
;写出实验室制取DB2的化学方程式:
(4)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式
查看习题详情和答案>>
(1)写出B的元素符号:B
O
O
,C的原子结构示意图

(2)B与D的氢化物较稳定的是
H2O
H2O
(填化学式),其中所含有的化学键类型为极性键
极性键
;(3)写出C2B2的电子式


Na2SO3+H2SO4═Na2SO4+H2O+SO2↑
Na2SO3+H2SO4═Na2SO4+H2O+SO2↑
(4)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式
HSO3-+H+=SO2↑+H2O
HSO3-+H+=SO2↑+H2O
.A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: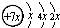 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素原子的核电荷数是
(6)A、B、C最高价氧化物的晶体类型是分别是
(7)画出D的核外电子排布图
 ,这样排布遵循了
,这样排布遵循了
查看习题详情和答案>>
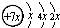 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:A
Si
Si
BNa
Na
CP
P
DN
N
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
HNO3
HNO3
,碱性最强的是NaOH
NaOH
.(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
F
F
,电负性最大的元素是F
F
.(4)D的氢化物比C的氢化物的沸点
高
高
(填“高“或“低“),原因氨气分子之间含有氢键
氨气分子之间含有氢键
(5)E元素原子的核电荷数是
26
26
,E元素在周期表的第四
四
周期,第Ⅷ
Ⅷ
族,已知元素周期表可按电子排布分为s区、p区等,则E元素在d
d
区.(6)A、B、C最高价氧化物的晶体类型是分别是
原子
原子
晶体、离子
离子
晶体、分子
分子
晶体(7)画出D的核外电子排布图


泡利
泡利
原理和洪特
洪特
规则.A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为  ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:B
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(3)已知元素周期表可按电子排布分为s区、p区等,则E元素在
(4)写出A的核外电子排布式
查看习题详情和答案>>
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:B
Na
Na
、CP
P
.(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
F
F
,电负性最大的元素是F
F
.(3)已知元素周期表可按电子排布分为s区、p区等,则E元素在
d
d
区.(4)写出A的核外电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)画出D的轨道表示式

(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素在周期表的第
(6)A、C最高价氧化物的晶体类型是分别是
查看习题详情和答案>>
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)画出D的轨道表示式


(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
HNO3
HNO3
,碱性最强的是NaOH
NaOH
.(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
F
F
.(4)D的氢化物比C的氢化物的沸点
高
高
(填“高“或“低“),原因:氨气分子之间含有氢键
氨气分子之间含有氢键
;D的液态氢化物是一种重要的溶剂,其性质与H2O相似,写出B与D的液态氢化物反应的化学方程式2Na+2NH3═2NaNH2+H2↑
2Na+2NH3═2NaNH2+H2↑
.(5)E元素在周期表的第
第四周期第Ⅷ族
第四周期第Ⅷ族
族,已知元素周期表可按电子排布分为s区、p区等,则E元素在d
d
区.(6)A、C最高价氧化物的晶体类型是分别是
原子
原子
晶体、分子
分子
晶体. ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 .下列比较中正确的是( )
.下列比较中正确的是( )