网址:http://m.1010jiajiao.com/timu_id_61933[举报]
第Ⅰ卷(选择题21题,每题6分,共126分)
一、选择题(本题包括13小题。每小题只有一个选项最符合题意)
题号
1
2
3
4
5
6
7
8
9
答案
C
A
D
C
B
B
D
C
D
题号
10
11
12
13
14
15
16
17
答案
C
B
D
A
B
B
C
D
二、选择题(本题共4小题。在每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但选不全的得3分,有选错的得0分)
题号
18
19
20
21
答案
ABC
BD
CD
BC
第Ⅱ卷(非选择题10题,共174分)
 22. (18分)
22. (18分)
Ⅰ.(8分) 0.21 (4分) 0.60-0.61 (4分)
Ⅱ.(10分)
电路图如甲所示,………………………(6分)
(元件的代号未标明或标错的,酌情扣分)
实物图连线如乙所示……………………(4分)
23.(14分)解:(1)传输轮对铁板的摩擦力大小为:
 ……(4分)
……(4分)
(2)铁板在传输轮下加速时,由牛顿第二定律可得,加速度大小
 …………………………(3分)
…………………………(3分)
若铁板在传输轮下一直处于加速状态,并设离开传输轮时的速度大小为 ,由运动学公式有:
,由运动学公式有:
 ……………………………………………………………(2分)
……………………………………………………………(2分)
解得: ………………(1分)
………………(1分)
传输轮边缘线速度大小 ………(2分)
………(2分)
由于 ,所以铁板一直处于加速状态,铁板离开传输轮时的速度大小为
,所以铁板一直处于加速状态,铁板离开传输轮时的速度大小为 。(2分)(用时间、位移判断运动情况同样给分,未作判断扣4分)
。(2分)(用时间、位移判断运动情况同样给分,未作判断扣4分)

24.(18分)解:由题意,画粒子的运动轨迹如图所示,图中D为轨迹
与OP的交点。
(1)粒子从P运动到D需时
 …………………………………(3分)
…………………………………(3分)
粒子从D运动到O需时
 …………………………………………………(3分)
…………………………………………………(3分)
所以粒子从P点运动点O点的时间
 …………………………………………………………(2分)
…………………………………………………………(2分)
(2)设粒子的入射速度大小为 ,则粒子在甲、乙两区域内运动时的轨道半径分别为
,则粒子在甲、乙两区域内运动时的轨道半径分别为
 ……………………………………………………………………(2分)
……………………………………………………………………(2分)
 …………………………………………………………………(2分)
…………………………………………………………………(2分)
则有 ---------① …………………………………………………(1分)
---------① …………………………………………………(1分)
由几何关系,有:(R1 + R2)+ (R1 + R2)cos600 = L cos300 --------②……(3分)
由①②两式可解得, ………………………………………(2分)
………………………………………(2分)
25.(22分)(1) 如图,设绝缘轨道半径为R,A到板N的距离为d,AB的竖直距离为y,C到板N的距离为x;到达最低点D的速度为vD,到A点时的速度为vA ,到达孔B时的速度为vB 。
 球在离开A经B到C的过程中,竖直方向只受重力作用,故从A到B和从B到C的时间相等,并设从A到B的时间为t。(2分)
球在离开A经B到C的过程中,竖直方向只受重力作用,故从A到B和从B到C的时间相等,并设从A到B的时间为t。(2分)
则有: -----------------①…………(1分)
-----------------①…………(1分)
 -----------------②…………(1分)
-----------------②…………(1分)
由①②得, -----------③…………(1分)
-----------③…………(1分)
由题意, --------- ④………………(1分)
--------- ④………………(1分)
在水平方向上,有 ---------------⑤……(2分)
---------------⑤……(2分)
在竖直方向上,有 ------------⑥ ………(2分)
------------⑥ ………(2分)
则③④⑤⑥四式,解得板间场强的大小 ……(2分)
……(2分)
(2)从A到B的过程中,有  --------⑦…(2分)
--------⑦…(2分)
由题意 ------------------⑧
------------------⑧
由④⑦⑧三式可解得 ------------------⑨
------------------⑨
从D到A,根据机械能守恒,有
 -----------------⑩…(3分)
-----------------⑩…(3分)
 由⑨⑩ 三式可解得,轨道对小球的支持力
由⑨⑩ 三式可解得,轨道对小球的支持力  ………………(2分)
………………(2分)
由牛顿第三定律,得小球在最低点D对轨道的压力大小为 ……(1分)
……(1分)
(其它解法相应给分)
26.(12分)
(1) Cl2, SO2, Na2SO3 (各1分)
 (2)①2Cl― +
2H2O Cl2↑+ H2↑+ 2OH― (2分)
(2)①2Cl― +
2H2O Cl2↑+ H2↑+ 2OH― (2分)
②BaSO3 +2H+ + SO42― = BaSO4↓+ SO2↑+ H2O (2分)
(3)①变红色(1分); Cl2+SO2+2H2O=H2SO4+2 H Cl (2分)
②先变红后褪色(或褪色)(1分);变红是因为溶液呈酸性,褪色是因为氯气过量生成次氯酸使溶液褪色。 (1分)
27.(14分)
(1)减小(1分); 减小 (1分)
(2)<(1分);当0.5mol N2和1.5mol H2完全反应时,才能放出46.2kJ的热量,但此反应不
能进行到底,所以放热小于46.2kJ。(2分)(其它合理答案也给分)
(3)D(2分)
(4)33.3%(2分);100/27 L2?mol-2(单位写与不写都可以)(2分);减小(1分)
(5)A、D(2分)
28.(共17分)
Ⅰ.(7分)
(1)④ 过滤 (1分) 烘干 (1分)
⑤ 取最后几滴洗涤液,加入BaCl2溶液,若无浑浊,证明沉淀已洗净 (2分)
(2)① 相同时间内产生气体的体积(或产生相同体积气体所需要的时间) (2分)
② CuO的质量在反应前后是否发生改变(1分)
Ⅱ.(10分)
(3)A(1分) B C(1分)
赶走硫酸铵溶液中的溶解O2和容器①液面上部的O2(或避免Fe2+被氧化)(2分)
(4)① 1 5 8 5 1 4 (2分)
② 酸式 (1分); 当溶液变成紫红色且30s内不褪色 (1分)
③ 80% (2分)
29.(15分)
(1)羧基、羟基 (2分)
(2)② (1分)
(3) (2分)
(2分)
 (2分)
(2分)
(4)  (2分)
(2分)
或
5mol (2分)
(5)2种 (2分)  或
或  (2分)
(2分)
30.(28分)
 Ⅰ.(共18分,每空2分)
Ⅰ.(共18分,每空2分)
(1)光质、植物的部位、植物种类(写不全只得1分)
1和2或4和5(写一组只得1分)
(2)光合 暗反应 C3的还原
叶绿体、线粒体、细胞质基质(写不全只得1分)
(3)(2分)如图.
的点要对准。
Ⅱ.(共10分,每空2分)第一步:取三个玻璃缸,标号A、
B、C,各放入20只蝌蚪
第二步:A中加入适量的甲状腺激素,B中加等量的甲状腺抑制剂,C中不加
(或加等量的清水)
预测结果: B缸(加有甲状腺抑制剂) A缸(加有甲状腺激素)
排除因实验材料的差异造成对实验结果的影响
(只做2组不给分)
31.(共16分)(1)(每空2分)4 紫茎抗病:紫茎感病=1:1(未写出表现型只得1分)
3/4 配子
(2)①AAbb (1分) 全是紫茎感病(1分)
②AABb (1分) 紫茎抗病
F1 AABb
↓×
F2 AABB AABb AAbb
紫茎抗病 紫茎抗病 紫茎感病
1 : 2 : 1
(图解共4分,其中F2代基因型1分,比例1分、表现型1分,符号正确规范1分)
③乙(1分)
本资料由《七彩教育网》www.7caiedu.cn 提供!
(14分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]•3H2O。
42.2g K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
试回答下列问题:
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol•L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。则上述转化的重要意义在于 。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了;lg1.1×10-36=-35.96)
查看习题详情和答案>>
(14分)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] •3H2O。
42.2g K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。
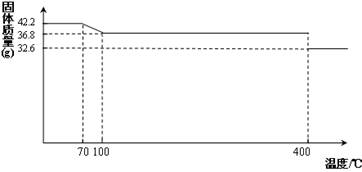
试回答下列问题:
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol•L-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=______________。
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。则上述转化的重要意义在于 。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了;lg1.1×10-36=-35.96)
查看习题详情和答案>>
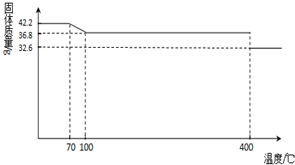 (2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.
(2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.42.2g K4[Fe(CN)6]?3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示.试回答下列问题:
(1)试确定150℃时固体物质的化学式为
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN).据此判断,烹饪食品时应注意的问题为
(3)在25℃下,将a mol?L-1的KCN溶液与0.01mol?L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a
(4)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O═2H2SO4的转化.已知,含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36.室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全
2013年底,上海青浦发生一家三口误食亚硝酸盐造成两男孩身亡的惨剧。常见的亚硝酸盐主要是亚硝酸钠(NaNO2),它是一种白色不透明晶体,虽然形状很像食盐,而且有咸味,但有毒。亚硝酸钠和氯化钠的部分资料如下表:
|
|
亚硝酸钠(NaNO2) |
氯化钠(NaCl) |
|
水溶性 |
易溶,溶液呈弱碱性 |
易溶,溶液呈中性 |
|
熔点 |
271℃ |
801℃ |
|
沸点 |
320℃会分解 |
1413℃ |
|
跟稀盐酸作用 |
有红棕色的NO2气体放出 |
无反应 |
完成下列填空:
(1)氮元素最外层电子排布式为________,氮原子核外电子共占据了___个轨道。亚硝酸钠中各元素原子半径由大到小依次为_________,亚硝酸的电离方程式为:_______________________。
(2)亚硝酸盐中毒是因为亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,即血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象.美蓝是亚硝酸盐中毒后的有效解毒剂.下列说法不正确的是( )
A.高铁血红蛋白的还原性比亚硝酸盐弱
B.药品美蓝应具有还原性
C.中毒时亚硝酸盐发生还原反应
D.解毒时高铁血红蛋白被还原
(3)NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须处理后才能排放。处理方法之一:在酸性条件下, NaNO2与KI的物质的量为1:1时恰好完全反应,且I-被氧化为I2,此时产物中含氮的物质(A)为________(填化学式)。若利用上述方法制A,现有两种操作步骤:①先将废水酸化后再加KI;②先将KI酸化后再加入废水。哪种方法较好?____(填序号。假设废水中其它物质不反应)
(4)如要鉴别亚硝酸钠和氯化钠固体,下列方法不可行的是
A.观察并比较它们在水中的溶解速度 B.测定它们各自的熔点
C.在它们的水溶液中滴加甲基橙 D.在酸性条件下加入KI淀粉试液
查看习题详情和答案>>
2013年底,上海青浦发生一家三口误食亚硝酸盐造成两男孩身亡的惨剧。常见的亚硝酸盐主要是亚硝酸钠(NaNO2),它是一种白色不透明晶体,虽然形状很像食盐,而且有咸味,但有毒。亚硝酸钠和氯化钠的部分资料如下表:
| | 亚硝酸钠(NaNO2) | 氯化钠(NaCl) |
| 水溶性 | 易溶,溶液呈弱碱性 | 易溶,溶液呈中性 |
| 熔点 | 271℃ | 801℃ |
| 沸点 | 320℃会分解 | 1413℃ |
| 跟稀盐酸作用 | 有红棕色的NO2气体放出 | 无反应 |
(1)氮元素最外层电子排布式为________,氮原子核外电子共占据了___个轨道。亚硝酸钠中各元素原子半径由大到小依次为_________,亚硝酸的电离方程式为:_______________________。
(2)亚硝酸盐中毒是因为亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,即血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象.美蓝是亚硝酸盐中毒后的有效解毒剂.下列说法不正确的是( )
A.高铁血红蛋白的还原性比亚硝酸盐弱
B.药品美蓝应具有还原性
C.中毒时亚硝酸盐发生还原反应
D.解毒时高铁血红蛋白被还原
(3)NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须处理后才能排放。处理方法之一:在酸性条件下, NaNO2与KI的物质的量为1:1时恰好完全反应,且I-被氧化为I2,此时产物中含氮的物质(A)为________(填化学式)。若利用上述方法制A,现有两种操作步骤:①先将废水酸化后再加KI;②先将KI酸化后再加入废水。哪种方法较好?____(填序号。假设废水中其它物质不反应)
(4)如要鉴别亚硝酸钠和氯化钠固体,下列方法不可行的是
A.观察并比较它们在水中的溶解速度 B.测定它们各自的熔点
C.在它们的水溶液中滴加甲基橙 D.在酸性条件下加入KI淀粉试液 查看习题详情和答案>>

 ----------------- …(2分)
----------------- …(2分)