网址:http://m.1010jiajiao.com/timu_id_61597[举报]
生物部分:1.A 2.C 3. D 4.C 5.D
30.(1)a应增加两组小白鼠的数量,避免偶然因素导致实验结果不准确甚至实验失败
b甲乙两组小白鼠的健康和生理状况应该一致
c实验前应先测定甲乙两组小白鼠的体温
d甲乙两组小白鼠应置于相同的较低温度(比如
(2)甲状腺激素和肾上腺素 神经??体液
(3)①神经系统兴奋性降低,精神萎靡 ②影响甲状腺激素的分泌,食欲减低 ③影响抗利尿激素的合成,尿量增加(任选两项,其它合理答案酌情给分)
(4)
测量次数(间隔4小时)
1
2
3
4
5
6
7
甲组鼠平均体温
乙组鼠平均体温
31.(1)正交、反交
(2)细胞质遗传 ①为母系遗传,②具有相对性状的亲本杂交,后代性状没有一定的分离比
(3)①细胞核遗传 ②如下图。
P: ♀DD × dd♂
右旋螺 ↓ 左旋螺
F1 Dd
右旋螺
↓自交
F2 1/4DD 2/4Dd l/4dd
右旋螺 右旋螺 右旋螺
↓自交 ↓自交 ↓自交
F3 1/4DD 2/4(1/4DD、2/4Dd、l/4dd) l/4dd
右旋螺(表现为母体基因型) 左旋螺
3 : 1
化学部分:6.B 7.D 8.A 9D
26.(12分)
(1)漏斗、玻璃棒 (2分) ;
(2)蒸发浓缩、冷却结晶 (2分)
(3)Cu+H2O2+H2SO4+3H2O=CuSO4?5H2O
(或Cu+H2O2+H2SO4=CuSO4+2H2O) (3分)
(4)途径Ⅱ(1分);滤液A是NaAlO2和NaOH溶液,途径Ⅰ直接向A中加入盐酸得到的AlCl3溶液中含大量NaCl杂质;途径Ⅱ通入CO2气体得到Al(OH)3沉淀,将Al(OH)3恰好溶解于盐酸中得到的是纯净的AlCl3溶液 (4分)
27.(16分)
 (1)C4H8O2 (2分) (2)3 (1分) (3)消去反应(1分)
(1)C4H8O2 (2分) (2)3 (1分) (3)消去反应(1分)

(5)
 |
28.(16分)
(1)c(1分)
(2)①(Ⅰ)饱和碳酸氢钠溶液;(1分)除去CO2中的HCl气体(1分)
(Ⅱ)吸收未反应完的NH3(1分)(答“防止倒吸”或“吸收CO2”不给分);
(Ⅲ)过滤(1分) 玻璃棒、漏斗、烧杯(3分)
②(Ⅰ)氨气极易溶解于水,能形成较大浓度的溶液,有利于二氧化碳吸收,生成更多的碳酸氢铵。(共2分)
(Ⅱ)增大气体与溶液接触面积,提高CO2的吸收率。(2分)
(3)83.6%(或0.863)(0.86也得分)(2分)
(4)用碳酸氢铵与适量饱和食盐水反应。(或往烧碱溶液中通入过量CO2;往饱和Na2CO3溶液中通入过量CO2等。其他合理方法均可;化学方程式也可。)(2分)
29.(16分)
(1)减小(2分)
(2)BC(2分)(只答一个且正确的给1分,错选1个0分)
(3)①b;②f(各3分)
(4)(6分)①0.60 ②>
物理部分:14.A 15.D 16.AB 17.A 18.B 19.C 20.B 21.BD
22.(1)(6分)
(2)(12分)(a)③ ② ⑤ ⑥(每空1分)
(b)二组(2分) (c)
 (每空3分)
(每空3分)
23.(15分)
(1)风突然停止,船体只受水的阻力f做减速运动,船体加速度大小 ,船只受水的阻力
,船只受水的阻力
(2)在单位时间内,对吹入帆船的空气(柱)应用动量定理.

 ∴
∴
24.(19分)
(1)在圆形磁场压内 ∴
∴ (6分)
(6分)
(2)粒子不从O3射出的条件
 ①
①
 ② (6分)
② (6分)
(3)导体棒匀速运动时,速度为
则 ∴
∴
则动量守恒 (7分)
(7分)
25.(20分)
(1) ∴
∴
(2)由功解关系得
 ∴
∴
两球碰后结合为C,C物之速v1 

(3)电场变化后 因 (向上)
(向上)
向下向心力  ∴
∴
不能作圆运动,而从底点作类平抛运动,经时间t,设在Q点绷紧.

 可得
可得
 故绳绷紧恰于水平位置,水平方向速度变为0,以竖直方向
故绳绷紧恰于水平位置,水平方向速度变为0,以竖直方向 作圆周运动,最高点速度设为
作圆周运动,最高点速度设为
 ∴
∴
 ∴
∴
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______(填字母标号).
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.

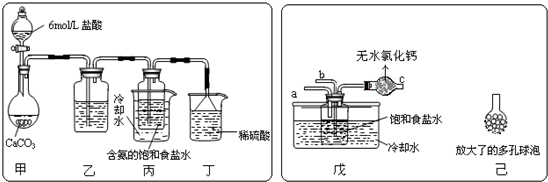
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是______,其作用是______;
(Ⅱ)丁装置中稀硫酸的作用是______;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是______(填分离操作的名称),该操作所需要的玻璃仪器有______.
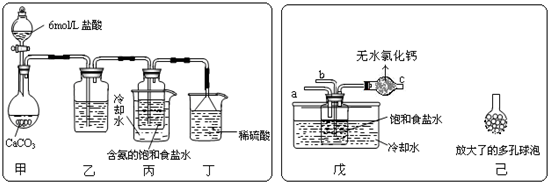
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入______气体,说明原因______.
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是______.
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为______.
(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:______.
查看习题详情和答案>>
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3
| ||
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______(填字母标号).
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是______,其作用是______;
(Ⅱ)丁装置中稀硫酸的作用是______;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是______(填分离操作的名称),该操作所需要的玻璃仪器有______.
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入______气体,说明原因______.
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是______.
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为______.
(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:______.
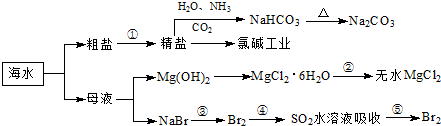
工业以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______(填字母标号).
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.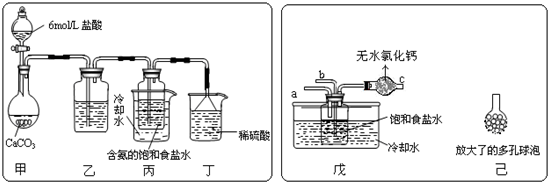
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是______,其作用是______;
(Ⅱ)丁装置中稀硫酸的作用是______;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是______(填分离操作的名称),该操作所需要的玻璃仪器有______.
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入______气体,说明原因______.
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是______.
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为______.
(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:______.
查看习题详情和答案>>
回答下列有关问题.
(1)下列有关说法正确的是
A.目前国际上主要使用蒸馏法的“海水淡化”技术,得高纯度淡水
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和NaCl溶液制取金属钠
(2)写出第③步骤的化学反应方程式
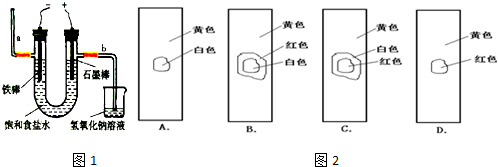
(3)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”. 氯气的工业制取装置如图1,回答:
①若饱和食盐水中含有酚酞,通电后
②电解反应的化学方程式为
③氯气制成氯水,用玻璃棒蘸取新制氯水滴在pH试纸中部,观察到的现象是
(4)工业上以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O═NH4HCO3;
NH4HCO3+NaCl═NaHCO3↓+NH4Cl;
2NaHCO3
| ||
某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图3所示(图中夹持、固定用的仪器未画出).试回答下列有关问题:
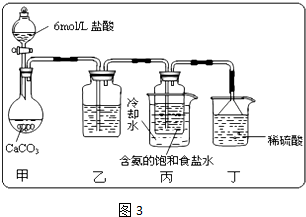
Ⅰ、乙装置中的试剂是
Ⅱ、丁装置中稀硫酸的作用是
Ⅲ、实验结束后,分离出NaHCO3 晶体的操作是
②碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为
③请你再设计出一种实验室制取少量碳酸氢钠的方法:
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3
| ||
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是
a.碳酸氢钠难溶于水 b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
d.碳酸氢钠的稳定性大于碳酸钠
(2)某活动小组根据上述制碱原理,进行碳酸氢钠的制备实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是
(Ⅱ)丁装置中稀硫酸的作用是
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从a管通入
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是
(3)碳酸氢钠受热所得固体12.28g与足量的石灰水充分反应,所得沉淀经洗涤、干燥质量为12.00g,则所得固体中碳酸钠的质量分数为
(4)请你再设计出一种实验室制取少量碳酸氢钠的方法:
