网址:http://m.1010jiajiao.com/timu_id_58481[举报]
一、选择题(本题包括13小题。每小题只有一个选项符合题意。)
1.D 2.A 3.C 4.B 5.C 6.B 7.C 8.A 9.B 10.D 11.C 12.D
二、选择题(本题共6小题。在每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但选不全的得3分,有选错的得0分。)
13.D 14.BD 15.C 16.AB 17.B 18.A
第Ⅱ卷
必考部分
.files/image343.jpg) 第Ⅱ卷必考部分共9题,共157分。
第Ⅱ卷必考部分共9题,共157分。
19.(共18分,每空、图3分)
1.①B ②偏大
2.①如图所示(连线有错就得0分) ②.files/image156.gif)
③.files/image159.gif) ④
④.files/image347.gif) (
(.files/image349.gif) )
)
20.(15分)解:
海盗船先由静止开始做加速度逐渐减小的加速运动(3分),达到最大速度后做匀减速运动,直到静止。(2分)
由图像可求得海盗船匀减速运动的加速度大小为
.files/image351.gif)
.files/image353.gif) 内位移为:
内位移为:.files/image355.gif)
21.(19分)解:
1.设小明滑到.files/image114.gif) 点时速度为
点时速度为.files/image358.gif) ,根据机械能守恒定律得:
,根据机械能守恒定律得:
.files/image360.gif) 解得
解得.files/image362.gif)
在.files/image114.gif) 点,由牛顿第二定律:
点,由牛顿第二定律:.files/image365.gif)
.files/image367.gif)
可见乙同学的观点正确。
2.由(1)可知小明恰好能从.files/image114.gif) 点开始做平抛运动落地,须有:
点开始做平抛运动落地,须有:.files/image362.gif) 则小明在斜面轨道下滑的过程中,由动能定理:
则小明在斜面轨道下滑的过程中,由动能定理:
.files/image371.gif)
将.files/image358.gif) 代入数据解得:
代入数据解得:.files/image374.gif)
又平抛时间.files/image376.gif)
.files/image378.gif) 之间的距离为:
之间的距离为:.files/image380.gif)
20.(20分)解:
1.如图甲所示,粒子进入磁场中做匀速圆周运动,洛伦兹力提供向心力,即:
.files/image382.gif)
代入各已知数据可得轨道半径:.files/image384.gif)
2.由几何关系可知:图中.files/image386.gif)
.files/image388.gif)
在外圆磁场中轨迹对应的圆心角为240°
在内圆磁场中轨迹对应的圆心角为120°
则:.files/image390.gif)
3.粒子能在最短时间内返回A点必定同时满足两个条件:
.files/image392.jpg)
.files/image394.gif)
但是,当.files/image304.gif) ,
,.files/image397.gif) 时,
时,
.files/image399.gif)
粒子将射出磁场区域。
当.files/image401.gif) 时,
时,
.files/image403.gif) ,粒子返回A点的时间最短。
,粒子返回A点的时间最短。
此时粒子的运动轨迹如图乙所示
又粒子做圆周运动的周期.files/image405.gif)
.files/image407.gif)
23.(15分)
1.负 2.离子键和共价键
3.热 .files/image409.gif)
4.5.3 75% 吸
5..files/image411.gif)
24.(13分)
1..files/image413.gif)
2.提高.files/image415.gif) 的生成速率
的生成速率
3.AB 4.95%乙醇
5.加压降温 6..files/image417.gif)
25.(17分)
1.装置乙不应有瓶塞
2..files/image419.gif) (浓)
(浓).files/image421.gif)
(或.files/image423.gif) (浓)
(浓).files/image425.gif) ,其他合理答案也给分)
,其他合理答案也给分)
3.氢氧化钠溶液(或氢氧化钠溶液等)
4.
往一支试管中加入少量固体,加水溶解,在滴加几滴KSCN溶液
若溶液变为红色,说明该固体已变质;若溶液未变红色,说明该固体没有变质
5..files/image427.gif) (或
(或.files/image429.gif) )
)
6.催化剂(或加快反应速率) 7.3.4% (或0.034)
26.I
1.等于 2.适当提高温度 适当增加.files/image431.gif) 的浓度
的浓度
3..files/image433.gif) 、[H]、ATP(缺一不得分) 4.色素的数量
、[H]、ATP(缺一不得分) 4.色素的数量
II.
1.叶绿体 2.避免芽产生生长素的干扰
3.缺乏空白对照组
4.生长素浓度、黄化豌豆幼苗切段的长度、乙烯浓度
27.
1.常染色体隐性遗传 2..files/image435.gif)
3.女孩 生育女孩既不患甲病也不患乙病,生育男孩可能患乙病
4.在减数第二次分裂后期Y染色体的姐妹染色单体分开后同时进入一个精子中
28.1.④ 2.②
29.1.④ 2.③
30.
1.+3 >
2.紫外光具有的能量比蛋白质分子中重要的化学键C-C、C-N和C-S的键能都大,紫外光的能量足以使这些化学键断裂,从而破坏蛋白质分子
3..files/image437.gif) 12
12
4..files/image439.gif) 5.AC
5.AC
31.
1..files/image441.jpg)
2.氯原子(苯环未写不扣分) 取代反应
3..files/image443.jpg)
4..files/image445.jpg)
5.3种
取少量该有机物放入洁净的试管中,加入银氨溶液,水浴加热,若观察到试管内壁
附着一层光亮的眼镜,证明有机物分子中含有醛基。
32.1.植物组织培养(或植物细胞工程,细胞工程) 2.脱分化 再分化
3.透气透水(或对细胞无毒害) 能被微生物降解 (其他正确答案也可得分)
[实验一]探究浓硫酸的氧化性。
将实验室常用的药品放入如图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
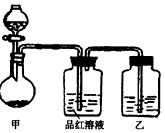
(2)写出装置甲中反应的化学方程式:______________________。
(3)装置乙中的试剂是_____________。
[实验二]探究某硫酸亚铁盐固体是否变质。
(4)请你帮助张明同学完成如下实验方案:

①取5. 00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中,加水稀释,再加稀硫酸酸化;
②用0. 100 0 mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19. 98 mL、20.02 mL。
回答下列问题:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为__________________。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消 失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是________________。
(7)原H2O2溶液中溶质的质量分数为_________。
张明同学在学习“硫酸及其盐的某些性质与用途”中,进行如下实验探究.
[实验一]探究浓硫酸的氧化性:将实验室常用的药品放入如图所示的实验装置后,加热装置甲.(夹持和加热装置省略)

(1)该装置设计上存在明显缺陷,请指出:________.
(2)写出装置甲中反应的化学方程式:________.
(3)装置乙中的试剂是________.
[实验二]探究某硫酸亚铁盐固体是否变质
(4)请你帮助张明同学完成如下实验方案:
[实验三]用KHSO4制取H2O2并测其质量分数
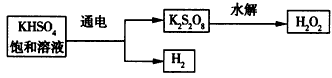
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
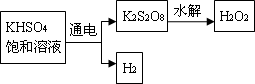
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:
(离子方程式:2MnO4―+5H2O2+6H+![]() 2Mn2++8H2O+5O2↑)
2Mn2++8H2O+5O2↑)
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
②用0.1000 mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL.
回答下列问题:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为________.
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快.Mn2+的作用是________.
(7)原H2O2溶液中溶质的质量分数为________.
(18分)
张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一]探究浓硫酸的氧化性
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
(1)该装置设计上存在明显缺陷,其缺陷是 _________________________________ ___。
(2)装置甲中反应的化学方程式是___________ ___。
(3)装置乙中的试剂是_____________________________________________________。
[实验二]探究某硫酸亚铁盐固体是否变质
(4)请你帮助张明同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
|
|
|
[实验三]用KHSO4制取H2O2并测其质量分数
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
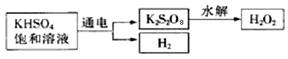
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
②用0.1000 mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00mL、19.98 mL、20.02 mL。
请回答:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________ ___。
(7)原H2O2溶液中溶质的质量分数是__________ _____ ____。
查看习题详情和答案>>
张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一
 ]探究浓硫酸的氧化性
]探究浓硫酸的氧化性 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略) (1)该装置设计上存在明显缺陷,其缺陷是 __________
(1)该装置设计上存在明显缺陷,其缺陷是 __________ _______________________ ___。
_______________________ ___。 (2)装置甲中反应的化学方程式是___________ ___。
(2)装置甲中反应的化学方程式是___________ ___。 (3)装置乙中的试剂是_____________________________________________________。
(3)装置乙中的试剂是_____________________________________________________。[实验二
 ]探究某硫酸亚铁盐固体是否变质
]探究某硫酸亚铁盐固体是否变质 (4)请你帮助张明同学完成如下实验方案:
(4)请你帮助张明同学完成如下实验方案:| 实验操作 | 预期现象和结论 |
 | |
 查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:

 张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑) ①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化; ②用0.1000 mol/L KMnO4溶液滴定;
②用0.1000 mol/L KMnO4溶液滴定; ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。 请回答:
请回答: (5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。 (6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________ ___。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________ ___。 (7)原H2O2溶液中溶质的质量分数是__________ _____ ____。
(7)原H2O2溶液中溶质的质量分数是__________ _____ ____。
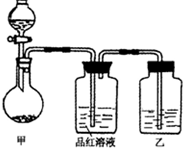 张明同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
张明同学在学习“硫酸及其盐的某些性质与用途“中,进行如下实验探究.
[实验一]探究浓硫酸的氧化性
将实验室常用的药品放入如图所示的实验装置后,加热装置甲.(夹持和加热装置省略)
(1)该装置设计上存在明显缺陷,请指出:______.
(2)写出装置甲中反应的化学方程式:______.
(3)装置乙中的试剂是______.
[实验二]探究某硫酸亚铁盐固体是否变质
(4)请你帮助张明同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
| ______ | ______ |
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:

张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑)
①取5.00mL H2O2溶液(密度为1.00g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
②用0.1000mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL.
回答下列问题:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为______.
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快.Mn2+的作用是______.
(7)原H2O2溶液中溶质的质量分数为______. 查看习题详情和答案>>