网址:http://m.1010jiajiao.com/timu_id_58301[举报]
I.高炉炼铁的主要反应为Fe2O3+3CO2Fe+3CO2。
已知该反应的 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
(1)该时间范围内的平均反应速率v(CO2)=_________mol/L min
min
(2) 的最大转化率_________________。
(3)欲提高CO的平衡转化率,可采取的措施是_______________。
A.减少Fe的量 B.增加Fe2O3的量
C.升高反应温度 D.移出部分CO2
E.使用合适的催化剂 F.减少容器的容积
Ⅱ.已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
|
温度 |
K1 |
K2 |
|
973K |
1.47 |
2.38 |
|
1173K |
2.15 |
1.67 |
(4)通过表格中的数值可以推断:反应①的△H_ O。(填“>”“<”)
(5)现有反应③:该反应的平衡常数的数学表
达式K3=____。
(6)根据反应①和②可以推导出Ki,Kz和玛之间的关系式。K3=__________。据此关系式和上表数据,也能推断出反应③的△H_ _0(填“>”“<”)。
查看习题详情和答案>>
I.高炉炼铁的主要反应为Fe2O3+3CO2Fe+3CO2。
已知该反应的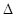 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
(1)该时间范围内的平均反应速率v(CO2)=_________mol/L min
min
(2) 的最大转化率_________________。
(3)欲提高CO的平衡转化率,可采取的措施是_______________。
| A.减少Fe的量 | B.增加Fe2O3的量 |
| C.升高反应温度 | D.移出部分CO2 |
Ⅱ.已知化学反应①:Fe(s)+CO2(g)
 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(4)通过表格中的数值可以推断:反应①的△H_ O。(填“>”“<”)
(5)现有反应③:该反应的平衡常数的数学表
达式K3=____。
(6)根据反应①和②可以推导出Ki,Kz和玛之间的关系式。K3=__________。据此关系式和上表数据,也能推断出反应③的△H_ _0(填“>”“<”)。 查看习题详情和答案>>
高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO (g)  Fe(s)+ CO2(g) △H>0
Fe(s)+ CO2(g) △H>0
(1)此反应的平衡常数表达式为:K=
(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比 (填“增大”、“减小”或“不变”)。
(3)已知1100℃时,K= 0.263。某时刻测得高炉中c(CO2)=" 0.025" mol·L-1,c(CO)=" 0.1" mol·L-1,在这种情况下,该反应 (填“向正反应方向进行”或“向逆反应方向进行”或“处于化学平衡状态”)。
(4)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H-H键能为436 kJ/mol,氧气分子中 O=O键能为498 kJ/mol,则水分子中O-H键的键能为 kJ/mol 。若1 g水蒸气转化成液态水时放热2.5 kJ,则反应H2(g) + 1/2O2(g) == H2O(l)的\
△H= kJ/mol
高炉炼铁中发生的基本反应之一如下:
FeO(s)+ CO (g)  Fe(s)+ CO2(g) △H>0
Fe(s)+ CO2(g) △H>0
(1)此反应的平衡常数表达式为:K=
(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比 (填“增大”、“减小”或“不变”)。
(3)已知1100℃时,K= 0.263。某时刻测得高炉中c(CO2)=" 0.025" mol·L-1,c(CO)=" 0.1" mol·L-1,在这种情况下,该反应 (填“向正反应方向进行”或“向逆反应方向进行”或“处于化学平衡状态”)。
(4)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H-H键能为436 kJ/mol,氧气分子中 O=O键能为498 kJ/mol,则水分子中O-H键的键能为 kJ/mol 。若1 g水蒸气转化成液态水时放热2.5 kJ,则反应H2(g) + 1/2O2(g) == H2O(l)的\
△H= kJ/mol
查看习题详情和答案>>
FeO(s)+ CO (g)
 Fe(s)+ CO2(g) △H>0
Fe(s)+ CO2(g) △H>0(1)此反应的平衡常数表达式为:K=
(2)温度升高,达到新的平衡后,高炉内CO2与CO的体积比 (填“增大”、“减小”或“不变”)。
(3)已知1100℃时,K= 0.263。某时刻测得高炉中c(CO2)=" 0.025" mol·L-1,c(CO)=" 0.1" mol·L-1,在这种情况下,该反应 (填“向正反应方向进行”或“向逆反应方向进行”或“处于化学平衡状态”)。
(4)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H-H键能为436 kJ/mol,氧气分子中 O=O键能为498 kJ/mol,则水分子中O-H键的键能为 kJ/mol 。若1 g水蒸气转化成液态水时放热2.5 kJ,则反应H2(g) + 1/2O2(g) == H2O(l)的\
△H= kJ/mol