网址:http://m.1010jiajiao.com/timu_id_58291[举报]
下面是某化学学习小组的实验记录,请根据实验记录(部分需要补充)回答有关问题。
【研究课题】铜离子颜色的探究
 【资料卡片】
【资料卡片】
【交流讨论】
(1)以上所得溶液或物质呈天蓝色的化学粒子符号是 (写化学式,下同);实验步骤4中呈深蓝色的化学粒子符号是 ;使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是 。
(2)请写出实验步骤3中“其中一份加水稀释”的反应离子的方程式: 。
(3)有资料上介绍浓硝酸与铜丝反应后得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因 ,设计两种不同的简单的实验方法证明你的解释:
方案① ;
方案② 。
查看习题详情和答案>>下面是某化学学习小组的实验记录,请根据实验记录(部分需要补充)回答有关问题。
【研究课题】 铜离子颜色的探究
【资料卡片】
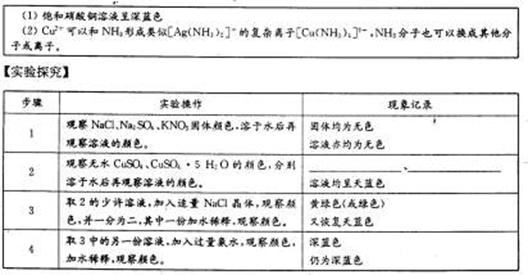
![文本框: (1)饱和硝酸铜溶液呈深蓝色
(2)Cu2+可以和NH3形成类似[Ag(NH3)2]+的复杂离子[Cu(NH3)4]2+,NH¬3分子也可以换成其他分子或离子。](http://thumb.zyjl.cn/pic1/2003/65/41/14/200365411404005514880917.files/image001.gif)
【实验探究】
| 步骤 | 实验操作 | 现象记录 |
| 1 | 观察NaCl、Na2SO4、KNO3固体颜色, 溶于水后再观察溶液的颜色。 | 固体均为无色 溶液亦均为无色 |
| 2 | 观察无水CuSO4、CuSO4?5 H2O的颜色, 分别溶于水后再观察溶液的颜色。 | 、 溶液均呈天蓝色 |
| 3 | 取2的少许溶液,加入适量NaCl晶体,观察颜色, 并一分为二,其中一份加水稀释,观察颜色。 | 黄绿色(或绿色) 又恢复天蓝色 |
| 4 | 取3中的另一份溶液,加入过量氨水,观察颜色, 加水稀释,观察颜色。 | 深蓝色 仍为深蓝色 |
【交流讨论】
(1)以上所得溶液或物质呈天蓝色的化学粒子符号是__ ____(写化学式,下同);4中呈深蓝色的化学粒子符号是__ ____。
(2)请写出实验步骤3中“其中一份加水稀释”的反应方程式: 。
(3)有资料上介绍浓硝酸与铜丝反应后所得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因_____________________________,设计两种不同的简单的实验方法证明你的解释:
方案①______________________________________________________________;
方案②______________________________________________________________。
查看习题详情和答案>>①配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中.
②盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下.静置,读取数据并记录为NaOH标准溶液体积的初读数.
③滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点.记录NaOH的终读数.重复滴定3次.
| 滴定次数 实验数据 |
1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
| V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
(1)步骤①中中还需补充的仪器有
(2)步骤③中你选择的酸碱指示剂是
(3)若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是
(4)样品总酸量=
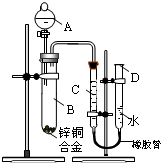 某学习小组用如右图所示装置测定锌铜合金中锌、铜的质量分数.
某学习小组用如右图所示装置测定锌铜合金中锌、铜的质量分数.(1)实验前,先将锌铜合金在稀酸中浸泡片刻,其目的是:
(2)实验操作步骤有:检查气密性,将药品和水装入各仪器中,连接好装置后,再进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥、称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂;⑤检查气密性.上述再进行的操作的顺序是
(填序号);记录C的液面位置时,除视线平视外,还应
(3)B中发生反应的化学方程式为:
(4)若实验用锌铜合金的质量为ag,与酸充分反应后,测得氢气体积为VL,为求出合金中锌、铜的质量分数,还缺少的一个数据是
A.反应前加入稀酸的体积B.反应前加入稀酸的质量分数C.实验前反应装置中空气的体积 D.实验条件下氢气的密度
(5)若实验用锌铜合金的质量为ag,与酸充分反应后,B中剩余固体的质量为bg,则锌的质量分数为
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得锌的质量分数将

(1)A中试剂为______________。
(2)实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是____________________________。
(3)检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤、洗涤、干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B中滴加足量试剂;⑤检查气密性。上述操作的顺序是___________;(填序号)记录C的液面位置时,除视线平视外,还应_______________。
(4)B中发生反应的化学方程式为_________________________________________________。
(5)若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为_______________。
(6)实验过程中,若未洗涤过滤所得的不溶物,则测得铝的质量分数将________(填“偏大”、“偏小”、“不受影响”)。
查看习题详情和答案>>