网址:http://m.1010jiajiao.com/timu_id_576823[举报]
一、选择题(每小题2.5分,共50分)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
D
B
D
C
D
B
A
B
C
题号
11
12
13
14
15
16
17
18
19
20
答案
C
C
D
C
A
D
C
B
C
A
二、填空题(每空2分,共28分)
21、(1)AlO2-;(2)Zn+2OH-=ZnO22-+H2↑ (3)①③④
22、(1)Fe3++3H2O Fe(OH)3+3H+ CaCO3+2H+===Ca2++CO2↑+H2O
Fe(OH)3+3H+ CaCO3+2H+===Ca2++CO2↑+H2O
(2)C
(3)HI是强电解质,使胶体聚沉;2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O
(4)①Fe(OH)3, 0.06mol;②0<X≤0.6
23.(1)P,第四周期第ⅥA族;
(2)SiO2+2OH-===SiO32-+H2O;
(3)2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑
三、实验题(每空2分,共20分)
24.(1)2、5、1、2、5、3 (2)0.2000;(3)ACD
25.(1)Cu2O或Fe2O3和Cu2O的混合物;
(2)取少许红色粉末溶于足量稀硫酸中,充分溶解后滴加KSCN溶液,再滴加双氧水;
有红色固体生成,加KSCN溶液不显红色,再加双氧水后显红色。
(3)①双氧水、碱式碳酸铜;②Fe(OH)3;③蒸发、浓缩、冷却、结晶。
四、计算题(10分)
26.(1)NH4+、Al3+、SO42-( (3分)
(2)NH4Al(SO4)2?12H2O[或(NH4)2SO4?Al2(SO4)3?24H2O] (4分)
 (3)
(3)
(3分)
某校化学研究学习小组设计如下实验方案,测定小苏打样品中纯碱的质量分数.
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算.实验中反应化学方程式为________.
(2)方案二:按下图装置进行实验,已知B中盛放的是浓H2SO4.回答以下问题:
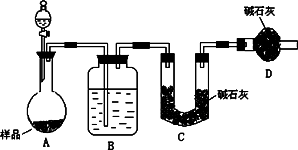
①实验加入药品前应先________________.分液漏斗中应该装________(填“盐酸”或“稀硫酸”).D装置的作用是________________.
②实验中除称量样品质量外,还需称________装置(用字母表示)前后质量的变化.
③根据此实验得到的数据,测定结果有较大误差.因为实验装置还存在一个明显缺陷,该缺陷是________________.
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤、洗涤、干燥沉淀,称量固体质量,计算.
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器是________.
②若加入试剂改为氢氧化钡,已知称得样品9.5 g,干燥的沉淀质量为19.7 g,则样品中碳酸钠的质量分数为________(保留一位小数).
得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的PH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |

试回答:
试剂1为
操作1中各步骤的名称为
步骤1:称取250g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将100mL 2mol?L-1盐酸加入灰中搅拌、过滤、洗涤.
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6~7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,得到滤液和沉淀.
步骤3:将步骤2所得的滤液稀释至500mL,取其中的25.00mL溶液以酚酞作指示剂,用0.1000mol?L-1的HCl标准溶液滴定,终点时消耗盐酸的体积为25.00mL,计算结果.
请回答下列问题:
(1)步骤 1中,使茶叶灰化需要的仪器有三角架、泥三角、酒精喷灯、
(2)步骤2中,改用试剂
(3)步骤3中,被滴定的25mL滤液中 CO32-的物质的量为
(4)原茶叶中钙离子的质量分数为
A.偏小 B.偏大 C.无影响 D.偏小或偏大或无影响.
得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的PH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |

试回答:
试剂1为______,试剂2为______(填字母),固体X的化学式是______;
操作1中各步骤的名称为______.
(1)方案一:称取一定质量的样品,置于坩埚中加热至恒重后,冷却,称量剩余固体质量,计算。实验中加热至恒重的目的是____。
(2)方案二:按下图装置进行实验。并回答以下问题:
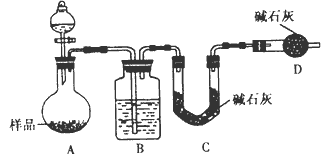
②实验中除称量样品质量外,还需称___装置(用字母表示)前后质量的变化;
③根据此实验得到的数据,测定结果有较大误差。因为实验装置还存在一个明显缺陷,该缺陷是____。
(3)方案三:称取一定量样品,置于小烧杯中,加适量水溶解,向小烧杯中加入足量氯化钡溶液,过滤洗涤,干燥沉淀,称量同体质量,计算:
①过滤操作中,除了烧杯、漏斗外还用到的玻璃仪器有___;
②实验中判断沉淀是否完全的方法是___;
③若加入试剂改为氢氧化钡,已知称得样品9. 5 g,干燥的沉淀质量为19.7 g,则 样品中碳酸钠的质量分数为___(保留一位小数)。