网址:http://m.1010jiajiao.com/timu_id_576640[举报]
一.选择题(本题包括8小题,每小题3分,共24分)
题号
1
2
3
4
5
6
7
8
答案
A
D
B
C
B
A
C
D
二.选择题(本题包括8小题,每小题3分,共24分)
题号
9
10
11
12
13
14
15
16
答案
B
AC
C
BC
AD
C
AD
D
三.(本题包括2小题,共20分)
17.(共8分)
(1)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O (2分)
(2)①不易控制反应。②产生有毒气体,造成污染环境。(2分)
(3)c; a、b。(2分)
(4)关闭a, b,打开c (1分) 用手捂住(热水、热毛巾、加热)试管② (1分)
(合理答案均给分)
18.(每空2分,共12分)
实验一:(1)反应物本身的性质对反应速率的关系;(2分)
温度相同;(2分)
(2)Mg(或Fe)和0.5mol/L硫酸和2mol/L硫酸;(2分)
测定一定时间产生气体的体积(或者测定一定体积的气体所需时间);(2分)
实验二:(1)催化剂(或硫酸锰或Mn2+的催化作用);(2分)
 (2)B
(2分)
(2)B
(2分)
四.(本题包括2小题,共20分)
19.(每空2分,共10分)
(1)0.1;(2)1.69;
(3)①c;②(参看右图)
(4)0<c(A)<0.2mol/L;(5)B
20.(每空2分,共10分)
(1) (2分)
(2分)
(2)均为氧化还原反应 (2分)
(3)3Fe+ 4H2O  Fe 3O4+4H2↑
(2分)
Fe 3O4+4H2↑
(2分)
(4)Fe+4H++2NO3-=Fe2++2NO2↑+2 H2O (2分)
(5)取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质 (2分)
五.(本题包括1小题,共12分)
21.(共12分)
(1)1S22S22P6;(2分)(2)H2S或NH2-;(2分)
(3)A;(2分)(4)BC;(2分)(5)20; (2分)
(6)Cu2++4H2O=[Cu(H2O)4]2+ (2分)
六.(本题包括1小题,共10分)
22.(共10分)
(1)B (2分)
(2)2H2O 2H2↑+O2↑
(2分)
2H2↑+O2↑
(2分)
(3) SO2+I2+2H2O 2HI+H2SO4 (2分)
2HI+H2SO4 (2分)
SO2和I2可循环使用,无污染。 (2分)
(4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。) (2分)
 七.(本题包括1小题,共10分)
七.(本题包括1小题,共10分)
23.(10分)
(1)134.4;
(2) (参看右图);
(3)0.068mol;
(4)
说明:本试卷中其他合理答案同样给分。
(7分)水在不同的温度和压力条件下可形成11种不同结构的晶体,密度从比水轻的0.92g?cm-3到约为水的一倍半的1.49 g?cm-3。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中在冰-Ⅶ中,每个氧有8个最近邻,其中与4个以氢键结合,O-H…O距离为295pm,另外4个没有氢键结合,距离相同。
3-1 画出冰-Ⅶ的晶胞结构示意图(氧用○表示,氢用o表示),标明共价键(―)和氢键(----),写出氧原子的坐标。
3-2 计算冰-Ⅶ晶体的密度。
查看习题详情和答案>>(12分)(1)H+可与H2O形成H3O+,H3O+中O原子采用  杂化,其键角比水分子 (填“大”或“小”)。
杂化,其键角比水分子 (填“大”或“小”)。
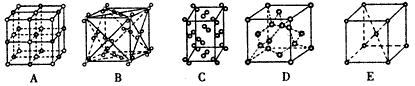
(2)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。上述五种晶体中晶体类型相同的是 ;(填写编号)。
(3)在冰的晶体中,每个水分子与相邻的 4 个水分子形成氢键(如图所示),已知冰的升华热(即 1 mol 水由冰转化为水蒸汽所需能量)是51KJ/mol,除氢键外,水分子间还存在范德华力(11 kJ / mol ) , 则冰晶体中氢键的“键能”(破坏 lmol 氢键所需的能量即为 氢键的“键能”)是 kJ / mol 。
氢键的“键能”)是 kJ / mol 。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag·cm-3, 表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
(5)在酸性溶液中,发生的氧化还原反应中被氧化与被还原的的元素的物质的量之比为2:5,
□KBiO3+□MnSO4+□H2SO4==□Bi2(SO4)3+□ +□ +□
写出Bi同主族第四周期元素的电子排布式:
(2)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。上述五种晶体中晶体类型相同的是______________;(填写编号)。

(5)在酸性溶液中,发生的氧化还原反应中被氧化与被还原的的元素的物质的量之比为2:5,
①___KBiO3+_____MnSO4+_____H2SO4==_____Bi2(SO4)3+_______+_______+_______
②写出Bi同主族第四周期元素的电子排布式:___________________。
 杂化,其键角比水分子 (填“大”或“小”)。
杂化,其键角比水分子 (填“大”或“小”)。(2)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。上述五种晶体中晶体类型相同的是 ;(填写编号)。

(3)在冰的晶体中,每个水分子与相邻的 4 个水分子形成氢键(如图所示),已知冰的升华热(即 1 mol 水由冰转化为水蒸汽所需能量)是51KJ/mol,除氢键外,水分子间还存在范德华力(11 kJ / mol ) , 则冰晶体中氢键的“键能”(破坏 lmol 氢键所需的能量即为
 氢键的“键能”)是 kJ / mol 。
氢键的“键能”)是 kJ / mol 。
(4)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag·cm-3,
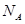 表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
表示阿伏加德罗常数,则CaO晶胞体积为 cm3。(5)在酸性溶液中,发生的氧化还原反应中被氧化与被还原的的元素的物质的量之比为2:5,
□KBiO3+□MnSO4+□H2SO4==□Bi2(SO4)3+□ +□ +□
写出Bi同主族第四周期元素的电子排布式:
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
(1)水分子中氧原子在基态时核外电子排布式为________;
(2)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体类型相同的是________(请用相应的编号填写)

(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是a kJ/mol,除氢键外,水分子间还存在范德华力(b kJ/mol),则冰晶体中氢键的“键能”是________kJ/mol;
(4)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.请写出生成此配合离子的离子方程式:________.