网址:http://m.1010jiajiao.com/timu_id_576609[举报]
一.选择题(本题包括8小题,每小题3分,共24分)
题号
1
2
3
4
5
6
7
8
答案
A
D
B
C
B
A
C
D
二.选择题(本题包括8小题,每小题3分,共24分)
题号
9
10
11
12
13
14
15
16
答案
B
AC
C
BC
AD
C
AD
D
三.(本题包括2小题,共20分)
17.(共8分)
(1)Cu+4H++2NO3-=Cu2++2NO2↑+2H2O (2分)
(2)①不易控制反应。②产生有毒气体,造成污染环境。(2分)
(3)c; a、b。(2分)
(4)关闭a, b,打开c (1分) 用手捂住(热水、热毛巾、加热)试管② (1分)
(合理答案均给分)
18.(每空2分,共12分)
实验一:(1)反应物本身的性质对反应速率的关系;(2分)
温度相同;(2分)
(2)Mg(或Fe)和0.5mol/L硫酸和2mol/L硫酸;(2分)
测定一定时间产生气体的体积(或者测定一定体积的气体所需时间);(2分)
实验二:(1)催化剂(或硫酸锰或Mn2+的催化作用);(2分)
 (2)B
(2分)
(2)B
(2分)
四.(本题包括2小题,共20分)
19.(每空2分,共10分)
(1)0.1;(2)1.69;
(3)①c;②(参看右图)
(4)0<c(A)<0.2mol/L;(5)B
20.(每空2分,共10分)
(1) (2分)
(2分)
(2)均为氧化还原反应 (2分)
(3)3Fe+ 4H2O  Fe 3O4+4H2↑
(2分)
Fe 3O4+4H2↑
(2分)
(4)Fe+4H++2NO3-=Fe2++2NO2↑+2 H2O (2分)
(5)取少量样品于试管中,加入KSCN溶液,如果出现红色,说明变质;反之,没有变质 (2分)
五.(本题包括1小题,共12分)
21.(共12分)
(1)1S22S22P6;(2分)(2)H2S或NH2-;(2分)
(3)A;(2分)(4)BC;(2分)(5)20; (2分)
(6)Cu2++4H2O=[Cu(H2O)4]2+ (2分)
六.(本题包括1小题,共10分)
22.(共10分)
(1)B (2分)
(2)2H2O 2H2↑+O2↑
(2分)
2H2↑+O2↑
(2分)
(3) SO2+I2+2H2O 2HI+H2SO4 (2分)
2HI+H2SO4 (2分)
SO2和I2可循环使用,无污染。 (2分)
(4)不现实,理由是现有的制取氢气方法耗能大,制取的成本太高,另外是氢气的熔沸点太低,给储存和运输带来困难。(或:现实,制取氢气用水为原料,来源丰富;氢气燃烧的产物是水,不会给环境带来任何污染等。) (2分)
 七.(本题包括1小题,共10分)
七.(本题包括1小题,共10分)
23.(10分)
(1)134.4;
(2) (参看右图);
(3)0.068mol;
(4)
说明:本试卷中其他合理答案同样给分。
(共13分)粗食盐中除含有CaCl2、MgCl2、Na2SO4等可溶性杂质外,还含有泥砂等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。已知:Mg(OH)2难溶于水,BaCO3难溶于水但可溶于盐酸,BaSO4既难溶于水又难溶于酸。
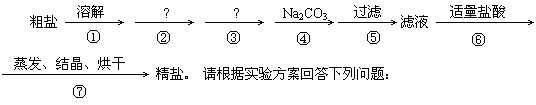 某同学设计了一种制备精盐的实验方案,步骤如下(每次用于沉淀的试剂均过量)
某同学设计了一种制备精盐的实验方案,步骤如下(每次用于沉淀的试剂均过量)
⑴粗盐的提纯,使用的主要仪器,合理的组合有
①漏斗、②烧杯、③蒸发皿、④酒精灯、⑤量筒、⑥试管夹、⑦玻璃棒、⑧集气瓶
A.①②③④⑦ B.①②③④⑤
C.①②③⑥⑧ D.②③④⑦⑧
⑵如何运用最简方法检验溶液中有无SO42-离子,所用试剂 溶液。如何检验SO42-离子是否除净简单操作为
⑶除去粗食盐中镁离子所用试剂为 溶液。
化学反应方程式
⑷请用化学反应方程式表示第④步中,加入过量Na2CO3溶液的作用:
⑸实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放置酒精灯,②固定铁圈位置,③放上蒸发皿(蒸发皿中盛有NaCl溶液),④加热搅拌,⑤停止加热
其正确的操作顺序为 。当出现 时就可以停止加热。
查看习题详情和答案>>将A g粗盐样品溶于水,所得溶液中含有Ca2+、Mg2+等杂质离子,现设计实验,采用常见的试剂,精制食盐溶液。回答下列问题:
(1)为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙。可将粗盐溶于水,此时可以观察到的实验现象为 。溶解时玻璃棒的作用为 。
(2)在步骤(1)之后进行下列五项操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。正确的操作顺序是________________(填代号)。
A.⑤④②①③ B.④①②⑤③ C.②⑤④①③ D.⑤②④①③
(3)在进行步骤(2)的实验中,检验SO42-沉淀是否完全的方法是
。
(4)检验提纯后的食盐溶液中是否含有SO42-的方法是:取少量溶液置于试管中,向溶液中加入足量的 ,然后加入几滴 溶液,若产生白色沉淀说明有SO42-;若不产生白色沉淀说明无SO42-。
(5)在蒸发NaCl溶液时,一般的有以下步骤:①放置酒精灯;②固定铁圈位置;③放上蒸发皿;④加热搅拌;⑤停止加热。正确的操作顺序是 。
(6)实验完毕得到Bg固体,则原样品中Na+质量为 g。
A.<23 A/58.5 B.> 23A/58.5 C.<23 B/58.5 D.> 23B/58.5
查看习题详情和答案>>将A g粗盐样品溶于水,所得溶液中含有Ca2+、Mg2+等杂质离子,现设计实验,采用常见的试剂,精制食盐溶液。回答下列问题:
(1)为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙。可将粗盐溶于水,此时可以观察到的实验现象为 。溶解时玻璃棒的作用为 。
(2)在步骤(1)之后进行下列五项操作:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。正确的操作顺序是________________(填代号)。
A.⑤④②①③ B.④①②⑤③ C.②⑤④①③ D.⑤②④①③
(3)在进行步骤(2)的实验中,检验SO42-沉淀是否完全的方法是
。
(4)检验提纯后的食盐溶液中是否含有SO42-的方法是:取少量溶液置于试管中,向溶液中加入足量的 ,然后加入几滴 溶液,若产生白色沉淀说明有SO42-;若不产生白色沉淀说明无SO42-。
(5)在蒸发NaCl溶液时,一般的有以下步骤:①放置酒精灯;②固定铁圈位置;③放上蒸发皿;④加热搅拌;⑤停止加热。正确的操作顺序是 。
(6)实验完毕得到Bg固体,则原样品中Na+质量为 g。
A.<23 A/58.5 B.> 23A/58.5 C.<23 B/58.5 D.> 23B/58.5
查看习题详情和答案>> 如图是实验室中制备气体或验证气体性质的装置图.
如图是实验室中制备气体或验证气体性质的装置图.(1)仪器a的名称是
(2)利用上图装置制备纯净、干燥的氯气.
①圆底烧瓶内发生反应的离子方程式为
| ||
| ||
②装置B中的溶液为
(3)利用上图装置证明SO2具有漂白性、还原性及生成气体中含有CO2.
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中匀为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水.
①证明SO2具有漂白性的装置是
②证明SO2具有还原性的现象是
③证明生成气体中含有CO2的现象是
④D装置的作用是