摘要:A...K+. B....Na+
网址:http://m.1010jiajiao.com/timu_id_576317[举报]
A、B、C、D、E、F属于短周期主族元素.A的原子半径在短周期中最大,B的一种原子中,质量数与质子数之差为零,C与D、E与F均同主族,C元素的原子L层电子数是K层的2倍,E原子的核外电子总数等于C、D原子核外电子总数的差.
(1)离子B-的结构示意图为
 ;化合物CE2的分子属于
;化合物CE2的分子属于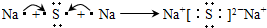
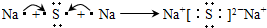 .
.
(2)A、E、F形成的简单离子的半径由大到小的顺序为
(3)由B、C可以构成的最简单的化合物W,取16.0g分子式为W?8H2O的化合物,将其释放的W完全燃烧生成液态水,可放出89.03kJ的热量,则W燃烧的热化学方程式为
(4)使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一.有人设计制造了一种燃料电池,一个电极通入富含E单质的气体和少量CE2,另一电极通入液化石油气(以C4H10表示),电池的电解质是熔融的K2CO3.该电池的负极反应式为
查看习题详情和答案>>
(1)离子B-的结构示意图为


非极性
非极性
分子(填“极性”或“非极性”);用电子式表示化合物A2F的形成过程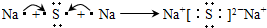
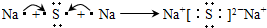
(2)A、E、F形成的简单离子的半径由大到小的顺序为
S2->O2->Na+
S2->O2->Na+
(用离子符号表示);元素C、D、E形成的常见单质中,熔沸点由高到低的顺序是(用名称表示)金刚石(石墨)>晶体硅>氧气
金刚石(石墨)>晶体硅>氧气
.(3)由B、C可以构成的最简单的化合物W,取16.0g分子式为W?8H2O的化合物,将其释放的W完全燃烧生成液态水,可放出89.03kJ的热量,则W燃烧的热化学方程式为
CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ?mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ?mol-1
.(4)使液化石油气氧化直接产生电流是新世纪最富有挑战性的课题之一.有人设计制造了一种燃料电池,一个电极通入富含E单质的气体和少量CE2,另一电极通入液化石油气(以C4H10表示),电池的电解质是熔融的K2CO3.该电池的负极反应式为
C4H10+13O2--26e-=4CO2+5H2O
C4H10+13O2--26e-=4CO2+5H2O
,电池工作时,电解质里的CO32-向负
负
极移动.A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A原子核外K层电子数为奇数,且A与C同主族;B原子最外层电子数占核外电子总数的
,D原子的最外层电子数与最内层电子数恰好相等,E原子最外层电子数比D原子最外层电子数多5.请回答下列问题:
(1)写出下列元素的符号:C
(2)由A、B、C三元素所形成的化合物的电子式为
(3)写出D的最高价氧化物对应水化物与E的最高价氧化物对应水化物反应的离子方程式
(4)由D单质参与的置换反应中,另一种单质对应元素的原子序数D元素的一半.写出该置换反应
查看习题详情和答案>>
| 3 |
| 4 |
(1)写出下列元素的符号:C
Na
Na
,ECl
Cl
.(2)由A、B、C三元素所形成的化合物的电子式为
Na+[:H]-
Na+[:H]-
,其晶体中所含化学键的类型有离子键和共价键
离子键和共价键
.在周期表内与B同族的元素(用R表示)与A形成的化合物A2R中,A2B的沸点是最高的,其原因是分子间存在氢键
分子间存在氢键
.(3)写出D的最高价氧化物对应水化物与E的最高价氧化物对应水化物反应的离子方程式
Mg(OH)2+2H+=Mg2++2H2O
Mg(OH)2+2H+=Mg2++2H2O
.(4)由D单质参与的置换反应中,另一种单质对应元素的原子序数D元素的一半.写出该置换反应
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
A、B、C、D、E、F、G都是短周期主族元素,它们的核电荷数依次增大.元素A的原子核内仅有一个质子,A、D同主族,B、C为同周期元素且与A能形成相同电子数的化合物,C与F同主族,F的质子数为C的2倍,元素E的最外层电子数比K层电子数多1,B、C、F的质子数之和等于E、G的质子数之和.请回答下列问题:
(1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式
(2)由A、C、D三种元素组成的一种常见化合物的电子式为
 .
.
(3)D、C、E、F四种元素的原子都能形成相应的离子,则离子半径大小关系为
查看习题详情和答案>>
(1)写出由上述至少两种元素组成的具有漂白作用的物质的化学式
H2O2
H2O2
、Na2O2
Na2O2
、SO2
SO2
、HClO(NaClO)
HClO(NaClO)
(写出四种).(2)由A、C、D三种元素组成的一种常见化合物的电子式为


(3)D、C、E、F四种元素的原子都能形成相应的离子,则离子半径大小关系为
S2->O2->Na+>Al3+
S2->O2->Na+>Al3+
(用离子符号表示).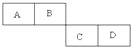 A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.
A、B、C、D四种短周期元素在周期表中的相对位置如表所示,A的单质与水蒸气反应可以制取水煤气.(1)B在元素周期表中位于
(2)A与氢元素可以形成很多化合物,在这些化合物中都含有
(3)Na 2C溶液呈碱性,其原因是
(4)用石墨电极电解NaD溶液,阴极产物是
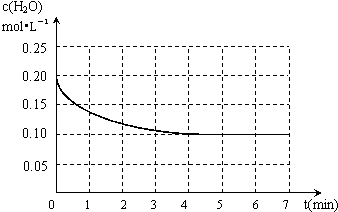
(5)一定温度下,在密闭容器内A的单质与水蒸气发生反应生成水煤气,水蒸气的浓度变化如下图:
反应达到平衡时的平均反应速率v=
(6)B的一种氢化物B2H4可在氧气中燃烧,可制成燃料电池,电解质溶液是KOH溶液.该电池的正极的电极反应式是