摘要:(1)低的先灭高的后灭.二氧化碳密度比空气大, 二氧化碳不燃烧也不支持燃烧(2)试管内液面上升.进入试管内的澄清石灰水变浑浊
网址:http://m.1010jiajiao.com/timu_id_570914[举报]
过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,同学们将包有Na2O2固体的棉花放入了如图1所示的装置中,发现高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭,同时也惊奇地发现棉花燃烧了起来.
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳具有
(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需满足
【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】
1.在常温下Na2O2与CO2、H2O均能发生化学反应.
2.无水硫酸铜为白色固体,吸水后变为蓝色.
【实验设计】经过讨论,同学们设计用如图2所示装置进行实验探究.
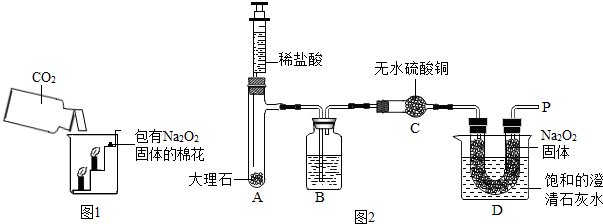
【实验步骤】
①检查整套装置的气密性;
②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放置一根带火星的木条,观察现象.
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响.
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊.
【实验分析】①B装置内盛放的试剂是
【实验结论】①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件.
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件.
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是
②写出Na2O2和CO2反应的化学方程式
【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数.
查看习题详情和答案>>
(1)实验过程中蜡烛由下往上依次熄灭,说明二氧化碳具有
CO2密度比空气大,CO2不能燃烧也不支持燃烧
CO2密度比空气大,CO2不能燃烧也不支持燃烧
的性质.(2)棉花为什么会燃烧呢?同学们认为棉花要燃烧,除了满足棉花是可燃物之外,还需满足
与氧气接触
与氧气接触
、温度达到着火点
温度达到着火点
.【提出问题】上述实验中是如何给棉花提供燃烧条件的?
【查阅资料】
1.在常温下Na2O2与CO2、H2O均能发生化学反应.
2.无水硫酸铜为白色固体,吸水后变为蓝色.
【实验设计】经过讨论,同学们设计用如图2所示装置进行实验探究.

【实验步骤】
①检查整套装置的气密性;
②把相关的试剂放入对应的仪器内;
③用力推动针筒的活塞,把稀盐酸注入试管内;
④一段时间后,在P处放置一根带火星的木条,观察现象.
注意:大理石与稀盐酸制取的CO2还会含有一定量的水蒸气,但整个实验过程中不考虑稀盐酸的挥发和空气对实验的影响.
【实验现象】
①带火星的木条复燃; ②无水硫酸铜没有变蓝色; ③饱和的澄清石灰水变浑浊.
【实验分析】①B装置内盛放的试剂是
浓硫酸
浓硫酸
;②D装置烧杯内澄清石灰水变浑浊的原因可能是Na2O2和CO2反应放出热量,使石灰水温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体
Na2O2和CO2反应放出热量,使石灰水温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体
,也可能是空气中的CO2与澄清石灰水反应生成了难溶物使澄清石灰水变混浊.【实验结论】①Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件.
②Na2O2和CO2反应过程中伴随能量变化,使图1中的棉花满足了燃烧的另一个条件.
【拓展提高】①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,学生甲认为生成的固体是NaOH,学生乙认为是Na2CO3,同学们经思考后认为甲同学的猜想是错误的,理由是
反应前后元素种类不变,反应物中没有氢元素所以不能生成NaOH
反应前后元素种类不变,反应物中没有氢元素所以不能生成NaOH
.②写出Na2O2和CO2反应的化学方程式
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
.【定量探究】有一包久置的过氧化钠粉末,现已证明因其保存不当导致完全变质成为NaOH和Na2CO3的混合物,同学们称取了13.25g样品,加入足量稀盐酸,并将产生的气体通入足量的澄清石灰水中,得到白色沉淀,经过滤、洗涤、烘干后称得其质量为10g,试计算:样品中Na2CO3的质量分数.
25、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
(1)实验过程中“下面的蜡烛先熄灭,上面的蜡烛后熄灭”的现象说明二氧化碳具有
(2)棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足a:
[提出问题]:在上述实验中是如何给棉花提供a和b这两个燃烧条件的呢?
[查阅资料]:1在常温下Na2O2和CO2能发生化学反应.
2无水硫酸铜为白色固体,吸水后变为蓝色.
[设计实验]:经过讨论后,小组同学设计了如下图2的实验进行探究.

[实验步骤]:①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有足量的Na2O2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针筒的活塞,把稀盐酸注入试管内;④一段时间后,在P处放置一根带火星的小木条,观察现象.
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响,B装置可除去二氧化碳气体中混有的水蒸气.
[实验现象]:①无水硫酸铜没有变蓝色;②带火星的小木条复燃;
③饱和的澄清石灰水变浑浊.
[实验分析]:①检查整套装置的气密性的方法:
②D装置的烧杯内澄清石灰水变浑浊的原因是
[得出结论]:①“小木条复燃”说明Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件;②“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应将
[拓展提高]:①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,小明认为生成的固体是NaOH,小红认为是Na2CO3,同学们经过思考后认为
②Na2O2和CO2反应的化学方程式是
查看习题详情和答案>>

(1)实验过程中“下面的蜡烛先熄灭,上面的蜡烛后熄灭”的现象说明二氧化碳具有
CO2密度比空气大
、CO2不能燃烧也不支持燃烧
的性质.(2)棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足a:
与氧气接触
、b:温度达到着火点
两个条件.[提出问题]:在上述实验中是如何给棉花提供a和b这两个燃烧条件的呢?
[查阅资料]:1在常温下Na2O2和CO2能发生化学反应.
2无水硫酸铜为白色固体,吸水后变为蓝色.
[设计实验]:经过讨论后,小组同学设计了如下图2的实验进行探究.

[实验步骤]:①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有足量的Na2O2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针筒的活塞,把稀盐酸注入试管内;④一段时间后,在P处放置一根带火星的小木条,观察现象.
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响,B装置可除去二氧化碳气体中混有的水蒸气.
[实验现象]:①无水硫酸铜没有变蓝色;②带火星的小木条复燃;
③饱和的澄清石灰水变浑浊.
[实验分析]:①检查整套装置的气密性的方法:
实验前在U型管内装入水,使U型管左右液面保持相平,然后向下推针筒活塞,若U型管左右形成液面差,且液面差保持不变则说明气密性良好.
②D装置的烧杯内澄清石灰水变浑浊的原因是
Na2O2和CO2反应放出热量,使石灰水温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体
.[得出结论]:①“小木条复燃”说明Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件;②“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应将
化学能
转化为热能,使图1中的棉花满足了燃烧的另一个条件.[拓展提高]:①Na2O2和CO2反应除生成一种气体外,还生成了一种固体,小明认为生成的固体是NaOH,小红认为是Na2CO3,同学们经过思考后认为
小明
同学的猜想是错误的,理由是:反应前后元素种类不变,反应物中没有氢元素所以不能生成NaOH
.②Na2O2和CO2反应的化学方程式是
2Na2O2+2CO2═2Na2CO3+O2
. 30、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.
30、过氧化钠(Na2O2)是一种淡黄色固体.在一次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入了如图1的实验中,发现了高低不同的两根蜡烛,下面的蜡烛先熄灭,上面的蜡烛后熄灭;同时也惊奇地发现棉花燃烧了起来.(1)实验过程中“下面的蜡烛先熄灭,上面的蜡烛后熄灭”的现象说明二氧化碳具有
密度比空气的大
、不支持燃烧
的性质.(2)棉花为什么会燃烧呢?小组同学认为棉花要燃烧,除了满足“棉花是可燃物”这一条件,还另需满足a:
棉花充分与氧气接触
、b:温度必须达到棉花的着火点
两个条件.[提出问题]:在上述实验中是如何给棉花提供a和b这两个燃烧条件的呢?
[查阅资料]:(1)在常温下Na2O2能和CO2发生化学反应.
(2)在常温下Na2O2能和水发生反应:2Na2O2+2H2O═4NaOH+O2↑
(3)无水硫酸铜为白色固体,吸水后变为蓝色.
[设计实验]:经过讨论后,小组同学设计了如图2的实验进行探究.

[实验步骤]:①检查整套装置的气密性;②把相关的试剂放入对应的仪器内(D装置的U型管内放有足量的Na2O2固体,烧杯内盛有饱和的澄清石灰水),并按图2组装整套实验仪器;③用力推动针筒的活塞,把稀盐酸注入试管内;④一段时间后,在P处放置一根带火星的小木条,观察现象.
注:整个实验中不考虑稀盐酸的挥发和空气对实验的影响.
[实验现象]:①无水硫酸铜没有变蓝色;②带火星的小木条复燃;
③饱和的澄清石灰水变浑浊.
[实验分析]:①检查整套装置的气密性的方法:
先在U型管内装入水,使U型管左右液面保持相平,然后向下推针筒活塞,若U型管左边液面下降,右边液面上升,并稳定一段时间则
说明气密性良好
.②C装置无水硫酸铜的作用是
证明CO2中的水蒸气确实已被除去
.③D装置的烧杯内饱和的澄清石灰水的作用是
析出氢氧化钙固体,说明Na2O2和CO2反应放出热量
.[得出结论]:(1)①“小木条复燃”说明Na2O2和CO2反应产生的一种气体,使图1中的棉花满足了燃烧的一个条件;②
③饱和的澄清石灰水变浑浊
(填装置出现的现象)说明Na2O2和CO2反应使图1中的棉花满足了燃烧的另一个条件.(2) Na2O2和CO2反应除生成一种气体外,还生成了一种固体,甲认为生成的固体是NaOH,乙认为是Na2CO3,同学们经过思考后认为甲同学的猜想是错误的,理由是:
没有水参与反应
.(3)Na2O2和CO2反应的化学方程式是
2Na2O2+2CO2═2Na2CO3+O2↑
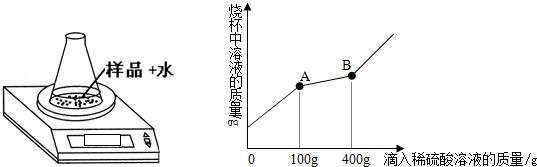
.[拓展提高]:现有一包保存不当的过氧化钠粉末,已证明其已完全变质.为探究其成分,有同学设计了以下定性和定量两种实验方案,请你帮助完成下列实验报告.
一、定性方案:

二、定量方案:
称取39.8g样品于一只质量为45g的锥形瓶中,一次性加入20mL蒸馏水后将锥形瓶放置在电子天平上,逐滴滴加溶质质量分数为9.8%的稀硫酸,观察显示数字的变化,并绘制出混合溶液的质量与所滴入稀硫酸溶液的质量关系曲线(如图);请你根据曲线计算出粉末中各成分的质量.
某班级同学对二氧化碳的实验室制取与性质若干问题进行如下探究:
[实验一]:实验室制取二氧化碳的原料的选择,实验内容和现象记录如下
[实验二]:选择与设计实验发生装置
(3)写出标号仪器名称:①
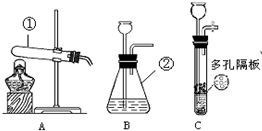
(4)实验室制取二氧化碳的反应文字表达式为
(5)不能用于制取二氧化碳的装置为
(6)固体反应物放在
(7)装置C相对于装置B,在操作方面的主要优势为:
①使反应随时发生或停止 ②可控制反应的速率 ③可以生成更多的CO2
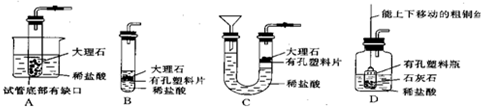
(8)某学生在上述装置的基础上进行改进,又设计了下图所示的四套装置来制取CO2,其中在制取时不能使反应随时发生或停止的装置为
[实验三]:设计收集装置,探究收集方法
(9)排空气收集时,集气瓶中导管应处的位置是
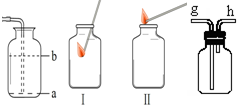
(10)用排水法收集气体之前,先要在集气瓶中装满
(11)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
资料:过量的二氧化碳使石灰水变浑浊后,还可以再反应得到澄清溶液.
[拓展研究]:由于化学反应前后元素的种类与质量守恒.
(12)请计算,欲制取3.3g二氧化碳气体,至少需使用纯度(碳酸钙与石灰石的质量比)为75%的石灰石(杂质不能反应生成二氧化碳)多少克?(请写出计算过程)
查看习题详情和答案>>
[实验一]:实验室制取二氧化碳的原料的选择,实验内容和现象记录如下
| 实验 操作 |
 |
 |
 |
| 现象 | 剧烈反应,产生大量气泡,反应迅速停止 | 产生气泡,速率迅速减慢,反应几乎停止. | 产生气泡,反应持续时间较长 |
| 分析 | 反应速率过快,气体不便收集 | 无法持续产生CO2 | 反应速率适中,可持续产生CO2,便于收集 反应速率适中,可持续产生CO2,便于收集 |
| 结论 | 实验室制取二氧化碳的原料是 块状大理石和稀盐酸 块状大理石和稀盐酸 . | ||
(3)写出标号仪器名称:①
试管
试管
②锥形瓶
锥形瓶

(4)实验室制取二氧化碳的反应文字表达式为
碳酸钙+盐酸→氯化钙+水+二氧化碳
碳酸钙+盐酸→氯化钙+水+二氧化碳
;(5)不能用于制取二氧化碳的装置为
A
A
(填字母序号);(6)固体反应物放在
多孔隔板上
多孔隔板上
(填“多孔隔板上”或“大试管底部”).(7)装置C相对于装置B,在操作方面的主要优势为:
①
①
①使反应随时发生或停止 ②可控制反应的速率 ③可以生成更多的CO2
(8)某学生在上述装置的基础上进行改进,又设计了下图所示的四套装置来制取CO2,其中在制取时不能使反应随时发生或停止的装置为
B
B
.
[实验三]:设计收集装置,探究收集方法
(9)排空气收集时,集气瓶中导管应处的位置是
a
a
(填“a”或“b”);能够检验二氧化碳是否收集满的操作方法是Ⅱ
Ⅱ
(填“Ⅰ”或“Ⅱ”).
(10)用排水法收集气体之前,先要在集气瓶中装满
水
水
(物质),再将气体由导气管h
h
(填“g”或“h”)通入.(11)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
资料:过量的二氧化碳使石灰水变浑浊后,还可以再反应得到澄清溶液.
| 比较项目 | 排水集气法 | 向上排空气集气法 |
| 收集方法可行性分析 | CO2生成和从水中逸出速率远大于其溶解速率和与水反应速率 | CO2密度比空气大,且 不与空气反应 不与空气反应 . |
| 收集过程分析 | 集满现象: 集气瓶口有气泡冒出 集气瓶口有气泡冒出 |
“验满”分析:即便燃着木条熄灭,也难以确定空气完全排尽 |
| 向收集到的CO2中倒入等体积石灰水,振荡 | 先浑浊后变澄清所需时间较短 | 先浑浊后变澄清所需时间较长 |
| 由此得出结论 | ① 能 能 (填“能”或“不能”)用排水法收集CO2②用排水法收集的CO2纯度 高 高 (填“高”或“低”) | |
(12)请计算,欲制取3.3g二氧化碳气体,至少需使用纯度(碳酸钙与石灰石的质量比)为75%的石灰石(杂质不能反应生成二氧化碳)多少克?(请写出计算过程)
(一)学习了二氧化碳性质后,某课外活动小组为了探究二氧化硫(SO2)的某些性质,进行了以下探究实验:下图中从左向右依次是某同学做的实验及相应现象.
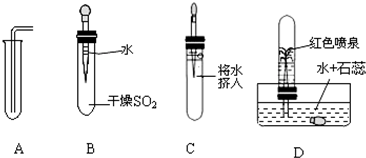
(1)通过上述实验,小明同学可得二氧化硫气体的二点性质,分别是:①
(2)A操作中,导气管要尽量接近试管底部,其目的是
(二)酒精灯的灯焰分三个部分,为了探究灯焰的温度,科研人员用特殊的测温装置进行实验,结果如下:
①根据上表数据,灯焰三部分温度由低到高的顺序为
②根据上表数据,加热实验时,被加热的仪器或物品应该放置在
③实验中,若燃着的酒精灯中酒精不足,现要添加酒精,采取的操作是:先
查看习题详情和答案>>

(1)通过上述实验,小明同学可得二氧化硫气体的二点性质,分别是:①
二氧化硫的密度比空气大
二氧化硫的密度比空气大
;②二氧化硫能溶于水且能与水反应
二氧化硫能溶于水且能与水反应
;(2)A操作中,导气管要尽量接近试管底部,其目的是
将试管内的空气排尽.
将试管内的空气排尽.
.(二)酒精灯的灯焰分三个部分,为了探究灯焰的温度,科研人员用特殊的测温装置进行实验,结果如下:
| 外焰温度 | 内焰温度 | 焰心温度 |
| 840 | 896 | 686 |
焰心<外焰<内焰
焰心<外焰<内焰
;②根据上表数据,加热实验时,被加热的仪器或物品应该放置在
外焰
外焰
位置较适宜.③实验中,若燃着的酒精灯中酒精不足,现要添加酒精,采取的操作是:先
熄灭酒精灯
熄灭酒精灯
;再向酒精灯中添加酒精.