网址:http://m.1010jiajiao.com/timu_id_555351[举报]
(每题2分)
题号
1
2
3
4
5
6
7
8
9
10
答案
B
D
C
A
A
B
B
B
B
A
题号
11
12
13
14
15
16
17
18
19
20
答案
B
C
A
D
B
D
C
B
C
C
21.(每空1分,共3分)ClO- 和 Cl-; 1
22.(6分,每空2分)(1)Na2SiO3+ CO2+ H2O= H2SiO3↓+ Na2CO3
(2)Na2SiO3+2HCl= H2SiO3↓+ 2NaCl
(3)Na2CO3+2HCl= 2NaCl+ CO2↑+ H2O
23.(4分,每空1分)A:CaBr2;B:AgNO3;C:CuSO4;D:K2CO3。
24.(7分,其中⑴2分,其余每空1分)⑴ ;
沸腾炉
;
沸腾炉
(2)SO3、SO2、O2;C、B、A (3)98%浓硫酸,接触室
25.(8分,每空2分) (1)CO2
(2)Al3++4OH- = AlO2-+ 2H2O
(3)2Al+3CuO 3Cu+Al2O3
3Cu+Al2O3
(4)0.75
26.(每空1分,共7分)
(1)甲 丙 戊
(2)乙 有较多气泡放出的为稀硫酸
(3)丁 浓硫酸不具有挥发性
27.(10分,其中(3)4分,(4)2分,其余每空1分)
(1)乙 亚铁盐在空气中易被氧气氧化 (2) 还原
(3) 2Fe2++H2O2+2H+=2Fe3++2H2O Fe3++3SCN-=Fe(SCN)3 。
(4)再加过量KSCN,如果变血红色,则第二种合理;如果不变色,则第一种合理 (5) 未能测其成分。
28.(7分,其中(1)3分,(2)4分) (1)3分 (2)55.79%
29.(8分)
(2分)(1)Al3+ + 3OH―= Al (OH)3↓;Al (OH)3 + OH―= AlO2―+ 2H2O
(6分)(2)1.5 mol?L―1或3.5 mol?L―1
已知:n (AlCl3)
=  = 0.1mol (1分)
= 0.1mol (1分)
n (Al (OH)3) =  = 0.05mol (1分)
= 0.05mol (1分)
①NaOH溶液不足 Al3+ + 3OH―= Al (OH)3↓
0.15mol 0.05mol
c (NaOH) =  = 1.5 mol?L―1 (2分)
= 1.5 mol?L―1 (2分)
②NaOH溶液过量Al3+ + 3OH―= Al (OH)3↓ Al (OH)3 + OH―= AlO2―+ 2H2O
0.1mol 0.3mol 0.1mol 0.05mol 0.05mol
c (NaOH) =  = 3.5 mol?L―1(2分)
= 3.5 mol?L―1(2分)
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2?CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL0.50mol?L-1的Cu(NO3)2溶液、2.0mL0.50mol?L-1的NaOH溶液和0.25mol?L-1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的条件是______.
②80℃时,所制得的孔雀石有少量褐色物质的原因是______.
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
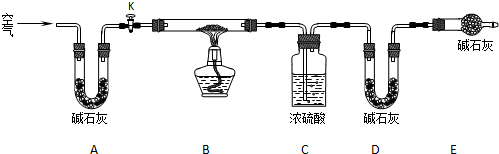
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:______.
步骤5:称量相关装置的质量.
①装置A的作用是______;若无装置E,则实验测定的x/y的值将______(选填“偏大”、“偏小”或“无影响”).
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的______(写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式______.
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
⑴孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L—1的Cu(NO3)2溶液、2.0mL 0.50 mol·L—1的NaOH溶液和0.25 mol·L—1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
| 编号 | V (Na2CO3)/ mL | 沉淀情况 | | 编号 | 反应温度/℃ | 沉淀情况 |
| 1 | 2.8 | 多、蓝色 | | 1 | 40 | 多、蓝色 |
| 2 | 2.4 | 多、蓝色 | | 2 | 60 | 少、浅绿色 |
| 3 | 2.0 | 较多、绿色 | | 3 | 75 | 较多、绿色 |
| 4 | 1.6 | 较少、绿色 | | 4 | 80 | 较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的条件是 。
②80℃时,所制得的孔雀石有少量褐色物质的原因是 。
⑵实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
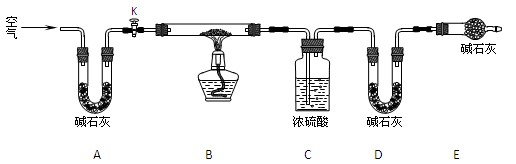
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: 。
步骤5:称量相关装置的质量。
①装置A的作用是 ;若无装置E,则实验测定的x/y的值将 (选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 (写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 。 查看习题详情和答案>>
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
⑴孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L—1的Cu(NO3)2溶液、2.0mL 0.50 mol·L—1的NaOH溶液和0.25 mol·L—1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
|
编号 |
V (Na2CO3)/ mL |
沉淀情况 |
|
编号 |
反应温度/℃ |
沉淀情况 |
|
1 |
2.8 |
多、蓝色 |
|
1 |
40 |
多、蓝色 |
|
2 |
2.4 |
多、蓝色 |
|
2 |
60 |
少、浅绿色 |
|
3 |
2.0 |
较多、绿色 |
|
3 |
75 |
较多、绿色 |
|
4 |
1.6 |
较少、绿色 |
|
4 |
80 |
较多、绿色(少量褐色) |
表Ⅰ 表Ⅱ
①实验室制取少许孔雀石,应该采用的条件是 。
②80℃时,所制得的孔雀石有少量褐色物质的原因是 。
⑵实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验:
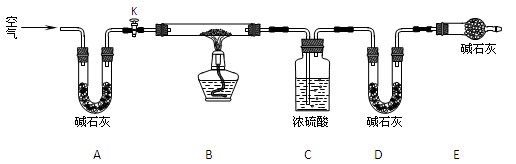
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4: 。
步骤5:称量相关装置的质量。
①装置A的作用是 ;若无装置E,则实验测定的x/y的值将 (选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的 (写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式 。
查看习题详情和答案>>
碱式碳酸铜是孔雀石的主要成分,加热时可分解为氧化铜、二氧化碳和水三种氧化物.
(1)若用下列仪器对分解产物中的非固体氧化物进行验证,仪器接口顺序是______(填字母).

按仪器连接顺序将仪器名称和对应仪器所装药品的名称填入下表.
| 仪器 | 试管 | ______ | ______ |
| 药品 | 碱式碳酸铜 | ______ | ______ |
(2)待(1)加热分解完全的试管冷却后,加入盐酸充分反应,CuO部分溶解,过滤:
①所得滤液中各种离子的物质的量浓度由大到小的顺序是______.
②将滤渣洗涤干燥,置于酒精蒸汽中并加热,黑色粉状固体逐渐变成红色固体,同时产生一种在常温下有刺激性气味的液体,该反应的化学方程式是______.
(3)将碱式碳酸铜与过量的木炭混合加热,也能得到(2)②所得的红色固体,该反应的化学方程式是______.
(4)铜及其合金用途广泛,常见的铜的合金有黄铜(铜锌合金)、青铜(铜锡合金)等.现有 w g黄铜样品,放入足量的稀盐酸中,产生V mL气体(标准状况下),则样品中铜和锌的物质的量之比是______(用含w、V的代数式表示). 查看习题详情和答案>>
(1)若用下列仪器对分解产物中的非固体氧化物进行验证,仪器接口顺序是______(填字母).
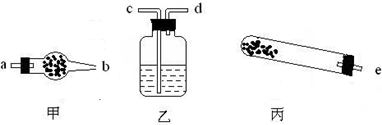
按仪器连接顺序将仪器名称和对应仪器所装药品的名称填入下表.
| 仪器 | 试管 | ______ | ______ |
| 药品 | 碱式碳酸铜 | ______ | ______ |
(2)待(1)加热分解完全的试管冷却后,加入盐酸充分反应,CuO部分溶解,过滤:
①所得滤液中各种离子的物质的量浓度由大到小的顺序是______.
②将滤渣洗涤干燥,置于酒精蒸汽中并加热,黑色粉状固体逐渐变成红色固体,同时产生一种在常温下有刺激性气味的液体,该反应的化学方程式是______.
(3)将碱式碳酸铜与过量的木炭混合加热,也能得到(2)②所得的红色固体,该反应的化学方程式是______.
(4)铜及其合金用途广泛,常见的铜的合金有黄铜(铜锌合金)、青铜(铜锡合金)等.现有 w g黄铜样品,放入足量的稀盐酸中,产生V mL气体(标准状况下),则样品中铜和锌的物质的量之比是______(用含w、V的代数式表示).