网址:http://m.1010jiajiao.com/timu_id_555035[举报]
一、选择题(50分)
1~5:BBACA w.w.w.k.s.5 u.c.o.m 6~10:DBBDC 11~15:CDCCB 16~20:ADBCC 21~25:DDBAB
二、简答题(20分)
26、(1)2Na+2H2O=2NaOH +H2
(2)2Al+2NaOH+2H2O = 2NaAlO2 +3 H2
27.①C ②D ③AB ④BE ⑤BD
 (2)① 取少量蒸馏水,向其中加入少量试样,能放出大量热的则为浓硫酸,应之为稀硫酸。②观察状态,浓H2SO4为粘稠液体,而稀硫酸为粘稠度较小的液体。③比较相同体积的酸的样品质量大小,浓硫酸质量较大,而稀硫酸则密度小。④取少量试样,向其中投入铁片,若产生大量气体的则为稀硫酸,若无明显现象(钝化),则为浓硫酸。⑤用玻璃棒蘸取试样在白纸上写字,立即变黑的为浓硫酸,反之则为稀硫酸。⑥取少量试样,分别投入一小块铜片,稍加热发生反应的为浓硫酸,无现象的为稀硫酸。(3)SO2和H2。浓硫酸与锌反应放出SO2气体,随着反应的进行浓硫酸变为稀硫酸,锌与稀硫酸反应放出H2。
(2)① 取少量蒸馏水,向其中加入少量试样,能放出大量热的则为浓硫酸,应之为稀硫酸。②观察状态,浓H2SO4为粘稠液体,而稀硫酸为粘稠度较小的液体。③比较相同体积的酸的样品质量大小,浓硫酸质量较大,而稀硫酸则密度小。④取少量试样,向其中投入铁片,若产生大量气体的则为稀硫酸,若无明显现象(钝化),则为浓硫酸。⑤用玻璃棒蘸取试样在白纸上写字,立即变黑的为浓硫酸,反之则为稀硫酸。⑥取少量试样,分别投入一小块铜片,稍加热发生反应的为浓硫酸,无现象的为稀硫酸。(3)SO2和H2。浓硫酸与锌反应放出SO2气体,随着反应的进行浓硫酸变为稀硫酸,锌与稀硫酸反应放出H2。
三、推断题(11分)
28.(1)A:SiO2;B:Na2SiO3 ;C:CO2 ;D:H2SiO3
(2)SiO2+4HF
== SiF4↑+2H2O
SiO2+Na2CO3  Na2SiO3
+CO2↑
Na2SiO3
+CO2↑
Na2SiO3+CO2+H2O
= H2SiO3↓+Na2CO3 H2SiO3 SiO2+H2O
SiO2+H2O
29.(1)FeCl2 KCl (2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Fe3++SCN-=Fe(SCN)2+ 2Fe3++Fe=3Fe2+
四、实验题(8分)
30.(1) ① 3Cu+8HNO3(稀)== 3Cu(NO3)2+2NO↑+4H2O
② 2NO+O2== 2NO2
(2) ① 有无色气泡产生,反应速度开始缓慢,逐渐加快;
② 试管中的气体由无色变为浅棕色,后又变为无色;
③ 试管中的溶液由无色变成浅蓝色;
④ 反应结束时,铜片全部溶解。
(3) ① 水进入试管,上升到一定高度
② 试管中气体的颜色由棕红色变为无色
五、计算题(共11分)
31.(6分)(1)97.3 % (2)2mol/L
32.(5分) ①
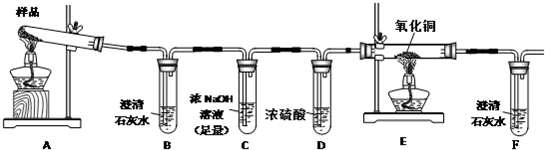
限选试剂:浓硫酸、1.0mol/LHNO3、1.0mol/L盐酸、1.0mol/LNaOH、3% H2O2、0.1mol/LKI、0,1mol/LCuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)若实验中,观察到B、F中溶液均变浑浊,则E中的现象是
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是
(3)固体产物中铁元素存在形式的探究.
提出合理假设:假设1:
设计实验方案证明你的假设(不要在答题卷上作答)
实验过程
根据上述实验方案进行实验.在答题卷上填写实验步骤、预期现象与结论中的空格.
| 实验步骤 | 预期现象与结论 |
| 步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使碳酸钾完全溶解.分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体. | 固体产物部分溶解. |
| 步骤2:向试管中加入适量 CuSO4 CuSO4 溶液,再加入少量不溶固体,充分振荡. |
(1)若溶液颜色及加入的不溶固体无明显变化,则假设 2 2 成立.(2)若溶液颜色明显改变,且有 暗红 暗红 色固体生成,则证明有铁单质 铁单质 存在 |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量 HCl HCl ,静置,取上层清液,滴加适量KSCN KSCN ,充分振荡后滴加H2O2 H2O2 . |
结合步骤2中的(2): (1)若溶液基本无色,则假设 1 1 成立(2)若溶液呈血红色,则假设 3 3 成立 |
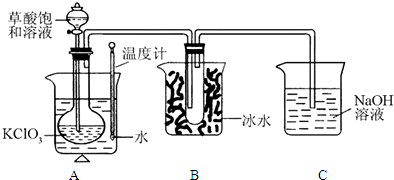
(1)该反应的反应原理为以下化学方程式,试配平:
(2)B装置的作用是
(3)C装置是尾气处理装置,反应一段时间后,C中含有NaOH、NaClO2、NaClO3等溶质,有同学说,C中还可能含有Na2CO3,试分析可能的原因
(4)某同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”,他将菠菜研磨成汁、热水浸泡、过滤得到溶液,调节溶液呈碱性,加入足量的CaCl2溶液,产生白色沉淀,过滤、洗涤,沉淀备用,对生成的沉淀进行探究.
①提出合理假设
假设1:只存在CaCO3;
假设2:既存在CaCO3,也存在CaC2O4;
假设3:
②基于假设2,设计实验方案,进行实验.请在答题卷上写出实验步骤以及预期现象和结论.限选实验试剂:1mol?L-1 H2SO4、0.1mol?L-1 HCl、0.01mol?L-1 KMnO4、澄清石灰水.
| 实验步骤 | 预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请配平该反应的化学方程式:(将化学计量数按顺序填在答题卷上)
(2)将不同最的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中,进行如下反应:
CO(g)+H2O(g)?CO2(g)+H2(g)
得到表中三组数据
| 实验 | 温度°C | 起始量/mol | 平均量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3条件下,反应物和生成物的起始量、平衡量都不知道,欲计算该条件下的化学平衡常数可
以利用实验
(3)已知在常温常压下:
①2CH3OH(I)+3O2(g)═2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)═2CO(g)△H=-566.0kJ/mol
③H2O(g)═H2O(I)△H═44.0kJ/mol
写出甲醇(CH2OH)不宪全燃烧生成一氧化碳和液态水的热化学方程式
(1)请完成该反应的化学方程式:(系数按顺序填在答题卷上)
(2)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式:
(3)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F,E和F均为空气的组成成分.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
| 物质 温度 |
活性炭(mol) | NO(mol) | E(mol) | F(mol) |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②根据上述信息判断,温度T1和T2的关系是(填序号)
a.T1>T2 b.T1<T2 c.无法比较
(4)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸.回答下列问题:
①所得溶液的溶质是
②溶液中下列关系正确的是
a.c(Na+)>c(CO
2- 3 |
- 3 |
b.c(Na+)>c(HCO
- 3 |
2- 3 |
c.c(Na+)=2c(CO
2- 3 |
- 3 |
d.c(H+)+c(Na+)=c(OH-)+2c(CO
2- 3 |
- 3 |
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的一定浓度的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为1.9×10-4mol/L,则混合后若生成沉淀所需原CaCl2溶液的最小浓度为