网址:http://m.1010jiajiao.com/timu_id_545112[举报]
第Ⅰ卷(必做,共88分)
一、选择题(每题4分,共60分)
1.A 【解析】 气体跨膜运输方式为自由扩散,一分子三磷酸鸟苷水解为一分子一磷酸鸟苷脱下两分子磷酸基团,所以GTP中应含有两个高能磷酸键。
2.D 【解析】 ④代表高尔基体,动植物细胞都含有。
3.B 【解析】 BC段表示每条染色体上含有两个DNA分子,即含有染色单体。
4.B 【解析】 两品种杂交所得的F1的基因型为AaBbDd,F2中符合育种要求的表现型为抗寒、抗倒伏、高蛋白的个体比例=1/4×1/4×3/4=3/64,基因型为aabbDD的比例=1/4×1/4×1/4=1/64。
5.B 【解析】 由于密码子的简并性,当转运RNA的反密码子发生突变时,密码子编码的氨基酸可能不发生改变,所以不一定影响蛋白质结构的变异。
6.C【解析】 这两对性状的遗传均与性别无关,并且F2的性状分离之比接近于9:3:3:1,遵循孟德尔的自由组合定律,所以这两对等位基因应位于两对常染色体上。
7.A 【解析】 生长激素是由垂体细胞合成分泌的,胰岛素是由胰岛B细胞合成分泌的。
8.D 【解析】 裸岩的群落演替过程中,生物种类增多,生态系统的抵抗力稳定性增强,恢复力稳定性减弱。
9.B【解析】本题目是对红色物质的性质给出了一个猜测,属于假设的研究方法。
10.A【解析】该装置是Fe和Pt在NaOH的碱性环境中形成原电池,实质为Fe的吸氧腐蚀,Pt为正极,电极反应为:O2
+ 2H2O +
4e- 4OH-,Fe为负极,电极反应为:Fe-2e-+
2OH-
4OH-,Fe为负极,电极反应为:Fe-2e-+
2OH- Fe(OH)2。
Fe(OH)2。
11.D【解析】A项中,两者均无酚羟基,不与FeCl3发生显色反应;B项中,两者均无醛基,不能发生银镜反应;C项中,苯丙烯酸1―丙烯酯含有碳碳双键,能够与溴水发生加成反应,杀虫剂“阿乐丹”不和溴水反应。
12.B【解析】A项中,S2-和ClO-能够发生氧化还原反应;B项各微粒可以在酸性溶液中大量共存;C项中,MnO4-和Fe3+有颜色;D项中,水电离产生的c(H+)=1×10-12mol/L的溶液的PH为12或2,HCO3-在两情况下均不能够存在。
13.用CH4催化还原NOx可以消除氮氧化物的污染,例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g);△H = -174kJ•mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g);△H = -1160kJ•mol-1
13.A【解析】A项中,H2O(g)生成H2O(1)需要放出热量,所以 △H < -574kJ•mol-1;
B项中,反应①②CH4均由-4价被氧化为CO2,所以转移的电子数均为8;C项中,将反应①②加和得:CH4(g)+2NO2(g)===N2(g)+CO2(g)+2H2O(g);△H =-1374kJ•mol-1.所以0.2molCH4还原NO2至N2同时生成气态水,放出的热量为173.4kJ;转移的电子数为0.2mol×8=1.60mol。
14.D【解析】A项中,品红溶液中同时通入Cl2、SO2,发生Cl2+SO2+2H2O=H2SO4+2HCl,失去漂白效果;B项中,SO2漂白后的物质在加热下,平衡向逆向移动,恢复原色,Cl2漂白后的物质在加热下不变色;C项中,“无色化合物”分子中存在一个饱和碳原子,类似甲烷的结构,所以不可能19个碳原子都在同一平面上。
15.A【解析】反应CO2(g) +
H2(g) CO(g) + H2O(g)在相同温度和压强下达到等效平衡的条件是“物料比相等”,将丁中CO和H2O的量转化为反应物,和乙完全相同,所以乙和丁中n (CO)相同;将丙中CO和H2O的量转化为反应物,和甲完全相同,所以甲和丙中n (CO)相同;因乙、丁中物料是甲、丙的两倍,所以乙、丁中n (CO)也是甲、丙的两倍。
CO(g) + H2O(g)在相同温度和压强下达到等效平衡的条件是“物料比相等”,将丁中CO和H2O的量转化为反应物,和乙完全相同,所以乙和丁中n (CO)相同;将丙中CO和H2O的量转化为反应物,和甲完全相同,所以甲和丙中n (CO)相同;因乙、丁中物料是甲、丙的两倍,所以乙、丁中n (CO)也是甲、丙的两倍。
16.解析:由于其运行轨道与地球运行轨道相同,所以轨道半径与地球的轨道半径相同,C答案正确;由开普勒第三定律, 可知,其围绕太阳运转的公转周期也可以确定,A答案正确。
可知,其围绕太阳运转的公转周期也可以确定,A答案正确。
答案:AC
17.答案:AB
解析:由A到B过程中,只有重力做功,由动能定理可知, ,所以线速度大小的平方v2随下落高度h变化的图象可能是AB
,所以线速度大小的平方v2随下落高度h变化的图象可能是AB
18.答案:AC
解析:由M到P,电场力对电子做正功,电势能减小,动能增加,速率增大;由P到N,电场力对电子做负功,电势能增加,动能减小,速率减小,所以答案为AC。
19.解析:以运动员为研究对象,运动员受到绳子的拉力和传送带给人的摩擦力。当重物m2保持静止时,绳子的拉力大小为m ;以重物为研究对象,
;以重物为研究对象, ,所以重物匀加速上升时,m1越大,传送带对运动员的摩擦力也越大,C答案正确。
,所以重物匀加速上升时,m1越大,传送带对运动员的摩擦力也越大,C答案正确。
20.解析:此题考查运动的合成与分解,球与甲运动员一起运动,共同具有相同的速度,被抛出时的速度是水平方向上两个速度的合速度,由平行四边形法则可知,D答案正确;同时,甲抛球时对球施加的水平方向推力应沿图中箭头1所指的方向,A答案正确。
答案:AD
21.答案:B
解析:由(甲)图可知在0―1 s内磁感应强度均匀增大,产生稳恒感应电流,根据楞次定律可判断感应电流的方向为逆时针,导体棒受到的安培力的方向是水平向左,棒静止不动,摩擦力方向水平向右,为正方向。同理,分析以后几秒内摩擦力的方向,从而得出ft图象为B图。
22.答案:D
解析:解析:由图可知,正弦波交流电的有效值为200V,由变压器电压比 可知,副线圈两端的电压为100V,代入部分电路的欧姆定律
可知,副线圈两端的电压为100V,代入部分电路的欧姆定律 可得与电阻串联的电流表的示数为
可得与电阻串联的电流表的示数为 。所以正确答案为D
。所以正确答案为D
第II卷(必做120+选做32分,共152分)
【必做部分】
23.(14分)(1)
(2)(I)D(2分) C(2分) (II)串联(1分)29900Ω(3分) (III)偏小(3分)
24.(16分)解:(1)研究木块m
F-μ2mg=ma1 …………2分
研究木板M
μ2mg-μ1(mg+Mg)=Ma2 …………2分
L= a1t2-
a1t2- a2t2
…………2分
a2t2
…………2分
解得:t=1s …………2分
(2)当F≤μ1(mg+Mg)时,f=0N …………2分
当μ1(mg+Mg)<F≤10N时,M、m相对静止
则有:F-μ1(mg+Mg)=(m+M)a
f=ma
即:f= -1(N)
…………2分
-1(N)
…………2分
当10N <F时,m相对M滑动,此时摩擦力f=μ2mg=4N …………2分

25.(18分)解:(1)粒子带正电,绕行方向为逆时针……………………………3分
(2)设上、下半圆中的速度相磁感应强度分别为V1,V2,B1,B2
则 ……………………………2分
……………………………2分
qE=mg………………………………………………2分
 …………………………2分
…………………………2分
 ……………………………………2分
……………………………………2分
 ………………………………………2分
………………………………………2分
解以上各式得v1= m/s……………………………2分
m/s……………………………2分
(3)撤去电场后mg=qv2B2……………………………2分
得r=
 26.(16分)⑴核糖体(2分)/X(2分);⑵遗传图解(4分);⑶①1/8(2分)/②
女(2分) ③Ⅱ(2分)/次级卵母细胞形成卵细胞过程中,染色体
26.(16分)⑴核糖体(2分)/X(2分);⑵遗传图解(4分);⑶①1/8(2分)/②
女(2分) ③Ⅱ(2分)/次级卵母细胞形成卵细胞过程中,染色体
的着丝点分裂后,两条子染色体进入同一个卵细胞(2分)。
27.(17分)Ⅰ⑴由向光侧向背光侧转移(1分);⑵对照作用
(1分);不支持(1分)/用现代物理化学方法测得向光侧
和背光侧的生长素含量基本相同(2分);⑶萝卜宁、黄质
醛等物质可能是生长抑制剂,从而抑制了向光侧的生长(2
分)。Ⅱ⑴生长素浓度(1分);梨释放的乙烯促进了柿子的成熟(2分);⑵清水(1分);盖玻片的一侧滴ABA溶液,在另一侧用吸水纸吸引、重复几次(2分) ①第二次镜检时,叶片上气孔关闭的数目比第一次明显增多(2分) ②视野中央(2分)。
28.(14分)
方案一:
(1)在白瓷板或玻璃片上放一小片pH试纸,将被测液滴到试纸上,过一会儿把试纸显示的颜色与标准比色卡较………………………………………………………………(2分)
方案二:
(1)赶走溶液中少量氧气,隔绝氧气………………………………………………(2分)
 (2)CO32―+H2O HCO3―+OH―
……………………………………………(2分)
(2)CO32―+H2O HCO3―+OH―
……………………………………………(2分)
(3)做对比实验,取上述NaOH溶液稀释,加入酚酞溶液出现红色且不褪去 (2分)
方案三:
(1)7 ……………………………………………………………………………………(2分)
(2)U形管中左边液面下降 …………………………………………………………(2分)
29.(12分)A.(1)NH3,HNO3;………………………………………(每空1分,共2分)
NH4NO3 N2O+2H2O………………………………………(2分)
N2O+2H2O………………………………………(2分)
(2)SO3;A B;………………………………………………………(每空1分,共3分)
H2S2O7或H2SO4?SO3或2SO3?H2O…………………………………………(1分)
B.(1) -78.7 ………………………………………………………(2分)
(2) CO(g) +2 H2(g)=CH3OH(l) △H = -128.1 kJ?mo1-1 ………(2分)
30.(16分)(1)加压既有利于增大反应速率,又有利于平衡正向移动,提高原料气的转化率;…………………………………………………………………………(2分)
催化剂在该温度条件下活性最高,反应速率大,达到平衡所需的时间短…………(2分)
(2)①增大压强;……………………(2分)t2―t3;……………………………(2分)
②4/a2………………………………………………………………………………(2分)
(3) ……………………………………………………………(2分)
……………………………………………………………(2分)
(4)CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.1kJ?mol-1…………(2分)
(5)N2+8H++6e-=2NH ………………………………………………………………(2分)
………………………………………………………………(2分)
31.[化学一化学与化学技术] (8分)
⑴碱 ………(1分) S2- + H2O HS-
+OH-
HS- + H2O
HS-
+OH-
HS- + H2O H2S
+OH-(可不写)…………………………………………………………(1分)
H2S
+OH-(可不写)…………………………………………………………(1分)
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)………………………(2分)
⑵2.7×10-3 …………………(1分) ⑶226.2 kJ?mol-1 ……………(1分)
⑷加入过量的炭,使充分被还原;……………………………………………(1分)
通入空气,带出气体,使平衡向右移动。………………………………………(1分)
32.[化学一物质结构与性质](8分)
(1)1s22s22p63s23p63d64s2…………………(1分) (2) Si………………(1分);
(3) SiC(1分); 因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,
SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高………(2分)。
(4)12……………………(1分); 4…………………………………(1分)
33.[化学―有机化学基础](8分)
(1)C12H10O5……………(1分) 3………………(1分) 4…………………(1分)
(2)①b………………………………(1分)
②CH3―C≡C―COOH……………………………(1分)
 ④4…………………………………………………………………………………(1分)
④4…………………………………………………………………………………(1分)
34.(8分)[生物―生物技术实践]⑴防止血液凝固;⑵磷酸缓冲液/洗脱血红蛋白;⑶透析(粗分离)/去除样品中分子量较小的杂质/凝胶色谱法/相对分子质量的大小;⑷纯度鉴定。
35.(8分)[生物―现代生物科技专题]⑴①/氨基酸对应的密码子/mRNA与DNA间的碱基配对原则;⑵反转录;⑶限制性核酸内切酶;⑷用促性腺激素进行超数排卵/减数第二次分裂中期;⑸进行同期发情处理。
36.[物理―物理3―3]【分析】①设压缩后气体的压强为P,活塞的横截面积为S, l0=
V= l S. 缓慢压缩,气体温度不变,由玻意耳定律:P0V0= P V (3分)
解出p=2×105Pa (1分)
②大气压力对活塞做功W1=P0S(l0- l)=1J,人做功W2=l0J, (1分)
由热力学第一定律: △U=W1+W2+Q (2分)
将Q=-2J等代人,解出△U=9J (1分)
37.[物理―物理3―4解析:(1)1,-x方向 (4分)
(2)①光在圆柱体中的传播速度

 (1分)
(1分)
②设光线PC经折射后经过B点,光路图如图所示
由折射定律有: ①(1分)
①(1分)
又由几何关系有:  ②(1分)
②(1分)
解①②得 
光线PC离直线AB的距离CD=Rsinα=10 cm(1分)
cm(1分)
则距离直线AB10 cm的入射光线经折射后能到达B点.
cm的入射光线经折射后能到达B点.
38.[物理―物理3―5]解析:
(1)由能量守恒可知,B与A碰撞中动能的损失

(2)B与A碰撞时动量、能量守恒



解得
化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用 温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
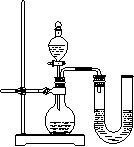
编号 | 盐酸 | NaOH溶液 | △t/℃ |
1 | 3.65﹪ | 2.00﹪ | 3.5 |
2 | 3.65﹪ | 4.00﹪ | x |
3 | 7.30﹪ | 8.00﹪ | 14 |
(1)表中x = 。
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。
⑶关于实验中的细节和意外情况:
①实验中,稀盐酸必须用胶头滴管逐滴滴加,这样做的目的是 。
②实验过程中,要用玻璃棒不断搅拌,这样做的目的是 。
③在实验过程中意外发现有气泡出现,你认为原因是 。
④发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:① 可能是NaOH;你认为:② 可能是__________; ③ 可能是_________________________。
查看习题详情和答案>>化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
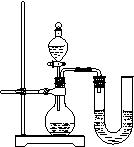
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65﹪ | 2.00﹪ | 3.5 |
| 2 | 3.65﹪ | 4.00﹪ | x |
| 3 | 7.30﹪ | 8.00﹪ | 14 |
(1)表中x = 。
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。
⑶关于实验中的细节和意外情况:
①实验中,稀盐酸必须用胶头滴管逐滴滴加,这样做的目的是 。
②实验过程中,要用玻璃棒不断搅拌,这样做的目的是 。
③在实验过程中意外发现有气泡出现,你认为原因是 。
④发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:① 可能是NaOH;你认为:② 可能是__________; ③ 可能是_________________________。
查看习题详情和答案>>【实验探究一】小云在试管中加入约2mL稀氢氧化钠溶液,滴入2滴酚酞溶液,振荡,溶液变为红色。然后向该试管中滴加稀盐酸,观察到溶液 ,证明氢氧化钠与盐酸发生了反应,该反应的化学方程式为 。
【反思评价】 小霞提出也可以使用石蕊试液代替无色酚酞进行上述实验。你认为 (填“无色酚酞”或“石蕊试液”)更适合用于验证二者恰好完全反应,你的理由是 。
【实验探究二】小兰同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65﹪ | 2.00﹪ | 3.5 |
| 2 | 3.65﹪ | 4.00﹪ | x |
| 3 | 7.30﹪ | 8.00﹪ | 14 |
表中x = 。
【反思评价】某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。但有同学认为单凭此现象不足以说明该反应放热,其理由是 。

【拓展延伸】不是所有的碱与盐酸反应都无明显现象,例如 (填一种碱)与盐酸反应就有明显的实验现象。
(8分)氢氧化钠与盐酸的反应无明显现象,某化学兴趣小组为证明氢氧化钠与盐酸发生了化学反应,进行了如下的实验探究。
【实验探究一】小云在试管中加入约2mL稀氢氧化钠溶液,滴入2滴酚酞溶液,振荡,溶液变为红色。然后向该试管中滴加稀盐酸,观察到溶液 ,证明氢氧化钠与盐酸发生了反应,该反应的化学方程式为 。
【反思评价】 小霞提出也可以使用石蕊试液代替无色酚酞进行上述实验。你认为 (填“无色酚酞”或“石蕊试液”)更适合用于验证二者恰好完全反应,你的理由是 。
【实验探究二】小兰同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65﹪ | 2.00﹪ | 3.5 |
| 2 | 3.65﹪ | 4.00﹪ | x |
| 3 | 7.30﹪ | 8.00﹪ | 14 |
表中x = 。
【反思评价】某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据
判断NaOH溶液与稀盐酸发生了中和反应。但有同学认为单凭此现象不足以说明该反应放热,其理由是 。

【拓展延伸】不是所有的碱与盐酸反应都无明显现象,例如 (填一种碱)与盐酸反应就有明显的实验现象。 查看习题详情和答案>>
I、实验方案
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,测得的pH逐渐变小直到pH小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
⑴反应后,所得溶液显 性(填“酸”、“碱”或“中”)
⑵用pH试纸测定NaOH溶液pH时,正确的操作是:
。
⑶简述强调“测得的pH小于7”的理由:
______________________________________________________________________________。
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
该组同学将不同浓度的盐酸和NaOH溶液各10 克混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
| 编号 | 盐酸 | NaOH溶液 | △t/℃ |
| 1 | 3.65﹪ | 2.00﹪ | 3.5 |
| 2 | 3.65﹪ | 4.00﹪ | x |
| 3 | 7.30﹪ | 8.00﹪ | 14 |
⑸某同学在没使用温度计的情况下,通过下图所示装置完成了实验。则该同学根据实验现象:
,判断NaOH溶液与稀盐酸发生了中和反应。

II、实验中的意外情况
在实验过程中,他们发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:①可能是NaOH;②可能是Na2CO3;③可能是NaOH和Na2CO3。
⑹小明同学取白色粉末少许,溶于水后,先向溶液中加入足量的 溶液,看到白色沉淀产生,然后向上层清液中加入酚酞试液,看到溶液呈红色,验证了猜想③是正确的。
⑺为了进一步研究,三位同学取了10.0g上述样品,利用电子天平共同做了下图所示的实验。


实验数据记录如下:
| 称 量 项 目 | 称 量 时间 | 质量(g) |
| 试样 | | 10.00 |
| 装置+稀硫酸质量 | | 241.20 |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 249.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 247.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 247.00 |
(8)有同学提出按上述实验所测得试样中Na2CO3质量分数会偏小,该同学的理由是(实验操作均正确): 。