网址:http://m.1010jiajiao.com/timu_id_5243[举报]
(一)选择题
1.BC2.B3.C.4.C5.C6.C7.B8.C9.BD10.AC11.BD12.D13.B14.C15.D.16.BC17.C18.B19.CD20.CD21.C22.D23.A24.CD25.A26.B27.C28.CD29.B30.A31.C32.(1)D(2)C33.C34.BC35.C36.D37.C38.D39.D40.B、C
(二)非选择题
1.(1)选用AgNO3溶液较好(CuSO4溶液次之,NaCl和H2SO4溶液更次之),①若电解NaCl、H2SO4溶液,产生的气体体积较难测定准确;②同样条件下,通过等量的电量,析出的Ag的质量大于Cu,因而称量和计算时产生的误差前者要小
(2)①电流强度;②电解(通电)时间;③电解产物的质量
(3)NA=
I:电流强度;t:通时间;mAg:析出银的质量MAg:Ag的摩尔质量。
2.(1)BH+2H2O4H2↑+BO―2
(2)pH愈小,反应速率愈大(3)1、16、8、7、4、7
3.DG+CO2M(D)==100D为MCO3,则M(M)=100-60=40M为Ca2+,A为Ca2+盐〔可溶性含氧酸钙盐可能为Ca(NO3)2〕,B为碳酸盐(可溶性碳酸盐有K+、Na+、NH+4……)
从EF+H2O,而F为非金属氧化物,则E含H、O及另一非金属,可推测E为NH4NO3
又:M(F)×+18×M(F)=44,氮的氧化物中N2O相对分子质量为44,和题意相符,可推得A:Ca(NO3)2、B:(NH4)2CO3、D:CaCO3、E:NH4NO3、F:N2O
4.13P4+10P2I4+128H2O32H3PO4+40PH4I
5.5、8、12、10、4、8、12;紫红色溶液褪去;不能用,因为KMnO4与HCl反应,HNO3的氧化性会干扰KMnO4的氧化性。
6.(1)2、5-n、2n、2、5-n、n+3(2)2、+6(3)B、C
7.(1)31.6,36.8,42.1(2)1.58×1024?(3)58.95L/mol(4)42.1g
8.(1)CO;(2)HF;(3)C+H2OCO+H2;(4)2F2+2H2O4HF+O2
9.(1)1cm3中阴、阳离子总数=
1cm3中Ni2+-O2-离子对数=
密度=
(2)设1molNi0.97O中含Ni3+xmol,Ni2+(0.97-x)mol,根据电中性;3xmol+2(0.97-x)mol=2×1mol,x=0.06
Ni2+为(0.97-x)mol=0.91mol
离子数之比Ni3+∶Ni2+=0.06∶0.91=6∶91
10.(1)1∶4;(2)0.12mol;(3)60%
11.(1)1∶50,增大O2量,平衡正向移动,提高SO2转化率(2)保证NH3∶SO2=2∶1(3)3.54t,0.912t.
12.(1)25%(2)2a(3)6(4)n>m
13.(1)BiCl3+H2OBiOCl↓+2HCl(2)不同意,因BiOCl中Cl为-1价而不是+1价。(3)将BiCl3溶解于含适量HCl的蒸馏水中(4)增大溶液中Cl―浓度,抑制BiCl3的水解。
14.(1)NH+Al3++2SO+2Ba2++4OH―2BaSO4↓+Al(OH)3↓+NH3↑+H2O
(2)Al(OH)3+OH―AlO+2H2O
15.(1)HCO+Br2HBrO+Br―+CO2↑
(2)2CO+Br2+H2O2HCO+Br―+BrO―
16.(1)该条件下D的密度ag/L;19.5+11.0-3.00L×ag/L;
(2)盐酸的物质的量浓度bmol/L;当×2≤0.01×b时,盐酸足量:V(H2)=×22.4L
当×2>0.01×b时,盐酸不足:V(H2)=×0.01×b×22.4L。
17.(1)CH3COOHCH3COO―+H+,CH3COO―+H2OCH3COOH+OH―,H2OH++OH―
18.(1)DABF→B→A→C→D→E
(2)2Cl―-2eCl2↑变蓝色Cl2+2I―2Cl―+I2
(3)①③④⑥(4)NA=
19.(1)
(2)N2+O22NO
112
说明氧气过量,过量2体积,根据NO和O2的反应
2NO+O2=2NO
212
说明反应后所得气体NO22体积,O21体积。故密闭容器中气体的体积为3体积。所以
(3)减少,不变。
20.A:NaOHB:NaNO3C:Ba(NO3)2D:HNO3X:MgSO4
(1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系.N2H4能发生下列反应:
N2H4+H3O+═N2H5++H2O N2H4+H2O?N2H5++
N2H5++H2O?N2H62++OH- N2H5++H2O?N2H4+H3O+
据此可得出的结论是
A.肼水解显酸性 B.肼在水中可电离出H+离子 C.肼是二元弱碱 D.肼是二元弱酸
(2)写出肼和H2O2反应的热化学方程式
(3)已知H2O(1)=H2O(g)△H=+44kJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是
(4)上述反应应用于火箭推进器,除释放出大量热量和快速生成大量气体产生巨大推力外,还有一个很突出的优点是
(5)用氨和次氯酸钠按物质的量之比2:1混合可生成肼,写出反应的化学方程式
(1)写出N2的电子式_________________________________。
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol.L-1NH4NO3溶液中水的电离程度___________(填“大于”“等于”或“小于”)0.1 mol·L-1NaOH溶液中水的电离程度。若将0.1 mOl·L-1NaOH和0.2 m01.L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为______________________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+====![]() + H2O
+ H2O
N2H4+ H2O![]()
![]() + OH-
+ OH-
![]() +H2O
+H2O![]()
![]() +OH-
+OH-
![]() +H2O
+H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是__________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)完成下列反应方程式并配平:
______NH3+______NaClO====NaCl+______N2H4+______ ______
(6)发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的热化学方程式)___________。
查看习题详情和答案>>发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)写出N2的电子式
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol·L-1 NH4NO3溶液中水的电离程度________________ (填“大于”、“等于“或“小于”)0.1 mol·L-l NaOH溶液中水的电离程度。若将0.1mol·L-1NaOH和0.2mol·L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为________________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+==N2H5++H2O N2H4+H2O![]() N2H5++OH-
N2H5++OH-
N2H5++H2O![]() N2H62++OH- N2H5++ H2O
N2H62++OH- N2H5++ H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)发射火箭时肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水。已知3.2gN2H4(l)在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式
________ 。
因此肼可以作为火箭推进剂。根据该反应,你认为是否可以通过改变反应条件,由N2和水来制取N2H4,若能,指出可能的反应条件;若不能,请指出原因。
。
查看习题详情和答案>>(1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系.N2H4能发生下列反应:
N2H4+H3O+═N2H5++H2O N2H4+H2O?N2H5++
N2H5++H2O?N2H62++OH- N2H5++H2O?N2H4+H3O+
据此可得出的结论是______.
A.肼水解显酸性 B.肼在水中可电离出H+离子 C.肼是二元弱碱 D.肼是二元弱酸
(2)写出肼和H2O2反应的热化学方程式______.
(3)已知H2O(1)=H2O(g)△H=+44kJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是______kJ.
(4)上述反应应用于火箭推进器,除释放出大量热量和快速生成大量气体产生巨大推力外,还有一个很突出的优点是______.
(5)用氨和次氯酸钠按物质的量之比2:1混合可生成肼,写出反应的化学方程式______,该反应的还原产物是______.
查看习题详情和答案>>
(1)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+=N2H5++H2O
N2H4+H2O
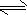 N2H5++OH-
N2H5++OH-N2H5++H2O
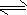 N2H62++OH-
N2H62++OH- N2H5++H2O
 N2H4+H3O+
N2H4+H3O+ 据此可得出的结论是______________。
A.肼水解显酸性
B.肼在水中可电离出H+离子
C.肼是二元弱碱
D.肼是二元弱酸
(2)写出肼和H2O2反应的热化学方程式_______________________。
(3)已知H2O(1)==H2O(g) △H=+44kJ/mol,则16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是___________________________。
(4)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是
_____________________。
(5)用氨和次氯酸钠按一定的物质的量之比混合可生成肼,写出反应的化学方程式__________________________,该反应的还原产物是___________________。