摘要:27.取 110-3mol?L-1的氨水,c(OH)=110-3mol?L-1的氨水,c(OH)=110-3mol?L-1的Ba(OH)2各aL分别与110-3mol?L-1的盐酸混合后.溶液均成中性.消耗盐酸的体积分别为b.c.d.则下列关系正确的是 A.a=b>c>d B.b>a=d>c C.b>a>d>c D. c>a=d>b第Ⅱ卷
网址:http://m.1010jiajiao.com/timu_id_52266[举报]
(2012?湛江一模)室温下,取0.3mol?L-1HY溶液与0.3mol?L-1NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是( )
查看习题详情和答案>>
A、B、C是三种常见短周期元素的单质.常温下D为无色液体,E是一种常见的温室气体.其转化关系如图(反应条件和部分产物略去).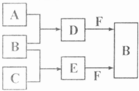 试回答:
试回答:
(1)E的电子式是
 .
.
(2)单质X和B或D均能反应生成黑色磁性固体Y,Y的化学式是
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等.Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18.Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是
(4)取0.3mol F与足量D充分混合后,所得溶液中再通入0.2mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)
(5)E的大量排放会引发很多环境问题.有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用.25℃,101kPa时,该反应的热化学方程式是
查看习题详情和答案>>
 试回答:
试回答:(1)E的电子式是


(2)单质X和B或D均能反应生成黑色磁性固体Y,Y的化学式是
Fe3O4
Fe3O4
.(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等.Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18.Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是
O3+2H++2I-=O2+I2+H2O
O3+2H++2I-=O2+I2+H2O
.(4)取0.3mol F与足量D充分混合后,所得溶液中再通入0.2mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)
c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
c(Na+)>c(OH-)>c(CO32-)>c(HCO3-)
.(5)E的大量排放会引发很多环境问题.有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用.25℃,101kPa时,该反应的热化学方程式是
CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-130.9kJ/mol
CO2(g)+3H2(g)=CH3OH(l)+H2O(1)△H=-130.9kJ/mol
.(已知甲醇的燃烧热△H=-726.5kJ?mol-1,氢气的燃烧热△H=-285.8kJ?mol-1)NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛.请回答下列问题:

(1)NH4Al(SO4)2可作净水剂,其理由是
(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol?L-1 NH4Al(SO4)2中c(NH
)
).
(3)如图1所示是0.1mol?L-1电解质溶液的pH随温度变化的图象.
①其中符合0.1mol?L-1 NH4Al(SO4)2的pH随温度变化的曲线是
②20℃时,0.1mol?L-1 NH4Al(SO4)2中2c(SO
)-c(NH
)-3c(Al3+)=
(4)室温时,向100mL 0.1mol?L-1 NH4HSO4溶液中滴加0.1mol?L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大是
查看习题详情和答案>>

(1)NH4Al(SO4)2可作净水剂,其理由是
Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水
Al3+水解生成的Al(OH)3具有吸附性,即Al3++3H2O═Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水
(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol?L-1 NH4Al(SO4)2中c(NH
+ 4 |
小于
小于
(填“等于”“大于”或“小于”)0.1mol?L-1 NH4HSO4中c(NH+ 4 |
(3)如图1所示是0.1mol?L-1电解质溶液的pH随温度变化的图象.
①其中符合0.1mol?L-1 NH4Al(SO4)2的pH随温度变化的曲线是
Ⅰ
Ⅰ
(填写序号),导致pH随温度变化的原因是NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小
NH4Al(SO4)2水解,溶液呈酸性,升高温度,其水解程度增大,pH减小
;②20℃时,0.1mol?L-1 NH4Al(SO4)2中2c(SO
2- 4 |
+ 4 |
10-3mol?L-1
10-3mol?L-1
(填数值).(4)室温时,向100mL 0.1mol?L-1 NH4HSO4溶液中滴加0.1mol?L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图2所示:试分析图中a、b、c、d四个点,水的电离程度最大是
a
a
点;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
.
有一种催化剂为铁的常见的氧化物,为探究该氧化物的成分:
(一)某同学将适量稀硝酸加入少许样品中加热溶解;取少许所得溶液,滴加KSCN溶液,出现红色,由此得出该氧化物中铁元素为+3价,你认为该结论 (合理或不合理),理由: .
(二)请你完成对该铁的氧化物成分的探究分析:
提出对该氧化物的合理假设:
a.假设1: ;
b.假设2:假设该氧化物为FeO;
c.假设3: .
(三):(请填写空格①和②)
查看习题详情和答案>>
(一)某同学将适量稀硝酸加入少许样品中加热溶解;取少许所得溶液,滴加KSCN溶液,出现红色,由此得出该氧化物中铁元素为+3价,你认为该结论
(二)请你完成对该铁的氧化物成分的探究分析:
提出对该氧化物的合理假设:
a.假设1:
b.假设2:假设该氧化物为FeO;
c.假设3:
(三):(请填写空格①和②)
| 实验操作 | 预期现象与结论 |
| 步骤1:用滴管取一定量3mol?L-1H2SO4于试管中,加热煮沸数分钟除去溶于其中的氧气 | / |
| 步骤2:用药匙取少量样品于试管中,用滴管加入适量除去氧气的3mol?L-1H2SO4并加热,充分反应得A溶液 | 固体溶解,溶液颜色有变化 |
| 步骤3:取少许A溶液于试管中,滴加1-2滴20%KSCN溶液,振荡 | ① |
| 步骤4:另取少许A溶液于试管中,滴加1-2滴0.2mol?L-1KMnO4溶液,振荡 | ② |