网址:http://m.1010jiajiao.com/timu_id_5220[举报]
(一)选择题
1.BC2.B3.C.4.C5.C6.C7.B8.C9.BD10.AC11.BD12.D13.B14.C15.D.16.BC17.C18.B19.CD20.CD21.C22.D23.A24.CD25.A26.B27.C28.CD29.B30.A31.C32.(1)D(2)C33.C34.BC35.C36.D37.C38.D39.D40.B、C
(二)非选择题
1.(1)选用AgNO3溶液较好(CuSO4溶液次之,NaCl和H2SO4溶液更次之),①若电解NaCl、H2SO4溶液,产生的气体体积较难测定准确;②同样条件下,通过等量的电量,析出的Ag的质量大于Cu,因而称量和计算时产生的误差前者要小
(2)①电流强度;②电解(通电)时间;③电解产物的质量
(3)NA=
I:电流强度;t:通时间;mAg:析出银的质量MAg:Ag的摩尔质量。
2.(1)BH+2H2O4H2↑+BO―2
(2)pH愈小,反应速率愈大(3)1、16、8、7、4、7
3.DG+CO2M(D)==100D为MCO3,则M(M)=100-60=40M为Ca2+,A为Ca2+盐〔可溶性含氧酸钙盐可能为Ca(NO3)2〕,B为碳酸盐(可溶性碳酸盐有K+、Na+、NH+4……)
从EF+H2O,而F为非金属氧化物,则E含H、O及另一非金属,可推测E为NH4NO3
又:M(F)×+18×M(F)=44,氮的氧化物中N2O相对分子质量为44,和题意相符,可推得A:Ca(NO3)2、B:(NH4)2CO3、D:CaCO3、E:NH4NO3、F:N2O
4.13P4+10P2I4+128H2O32H3PO4+40PH4I
5.5、8、12、10、4、8、12;紫红色溶液褪去;不能用,因为KMnO4与HCl反应,HNO3的氧化性会干扰KMnO4的氧化性。
6.(1)2、5-n、2n、2、5-n、n+3(2)2、+6(3)B、C
7.(1)31.6,36.8,42.1(2)1.58×1024?(3)58.95L/mol(4)42.1g
8.(1)CO;(2)HF;(3)C+H2OCO+H2;(4)2F2+2H2O4HF+O2
9.(1)1cm3中阴、阳离子总数=
1cm3中Ni2+-O2-离子对数=
密度=
(2)设1molNi0.97O中含Ni3+xmol,Ni2+(0.97-x)mol,根据电中性;3xmol+2(0.97-x)mol=2×1mol,x=0.06
Ni2+为(0.97-x)mol=0.91mol
离子数之比Ni3+∶Ni2+=0.06∶0.91=6∶91
10.(1)1∶4;(2)0.12mol;(3)60%
11.(1)1∶50,增大O2量,平衡正向移动,提高SO2转化率(2)保证NH3∶SO2=2∶1(3)3.54t,0.912t.
12.(1)25%(2)2a(3)6(4)n>m
13.(1)BiCl3+H2OBiOCl↓+2HCl(2)不同意,因BiOCl中Cl为-1价而不是+1价。(3)将BiCl3溶解于含适量HCl的蒸馏水中(4)增大溶液中Cl―浓度,抑制BiCl3的水解。
14.(1)NH+Al3++2SO+2Ba2++4OH―2BaSO4↓+Al(OH)3↓+NH3↑+H2O
(2)Al(OH)3+OH―AlO+2H2O
15.(1)HCO+Br2HBrO+Br―+CO2↑
(2)2CO+Br2+H2O2HCO+Br―+BrO―
16.(1)该条件下D的密度ag/L;19.5+11.0-3.00L×ag/L;
(2)盐酸的物质的量浓度bmol/L;当×2≤0.01×b时,盐酸足量:V(H2)=×22.4L
当×2>0.01×b时,盐酸不足:V(H2)=×0.01×b×22.4L。
17.(1)CH3COOHCH3COO―+H+,CH3COO―+H2OCH3COOH+OH―,H2OH++OH―
18.(1)DABF→B→A→C→D→E
(2)2Cl―-2eCl2↑变蓝色Cl2+2I―2Cl―+I2
(3)①③④⑥(4)NA=
19.(1)
(2)N2+O22NO
112
说明氧气过量,过量2体积,根据NO和O2的反应
2NO+O2=2NO
212
说明反应后所得气体NO22体积,O21体积。故密闭容器中气体的体积为3体积。所以
(3)减少,不变。
20.A:NaOHB:NaNO3C:Ba(NO3)2D:HNO3X:MgSO4
含Cr2O72-的酸性工亚废水会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转变为Cr(OH)3除去。工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓人空气。结果溶液的pH不断升高,溶液由酸性转为碱性。在以上处理过程中,溶液pH升高的原因是( )
A. 电解时废水体积减小
B. 鼓人空气使溶液中OH-浓度增大
C. 电解时H+在阴极被还原
D. Cr2O72-被还原为Cr3+时消耗了H+
查看习题详情和答案>>
A. 电解时废水体积减小
B. 鼓人空气使溶液中OH-浓度增大
C. 电解时H+在阴极被还原
D. Cr2O72-被还原为Cr3+时消耗了H+
查看习题详情和答案>>
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 ???????????????????????????????????? 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是????? (填序号)
A.Ba(NO3)2? ???? B.BaCl2? ?? ? C.Ba(OH)2??? ???? D.溶有NH3的BaCl2溶液
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为?????????????????????????? 。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
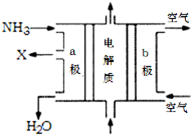
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作??????? 极(填“正”“负”“阴”或“阳”),其电极反应式为??????? ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为?????????? ,请判断T?????? 25℃(填“>”“<”“=”)。

查看习题详情和答案>>
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是 (填序号)
| A.Ba(NO3)2 | B.BaCl2 | C.Ba(OH)2 | D.溶有NH3的BaCl2溶液 |
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
 查看习题详情和答案>>
查看习题详情和答案>>
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是 (填序号)
| A.Ba(NO3)2 | B.BaCl2 | C.Ba(OH)2 | D.溶有NH3的BaCl2溶液 |
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作 极(填“正”“负”“阴”或“阳”),其电极反应式为 ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为 ,请判断T 25℃(填“>”“<”“=”)。
