��Ŀ����
��ҵ��ˮ�����ŷŻ����������Ⱦ�����ݳɷֲ�ͬ�ɲ��ò�ͬ�Ĵ���������
��1�����������ҵ��ˮ�г�����Cu2+���ؽ������ӣ�����FeS������������Ϊ��������ȥ����֪������Ksp(FeS)��6.3��10��18mol2��L��2��Ksp(CuS)��1.3��10��36mol2��L��2��
���������ӷ���ʽ˵���������ӵ�ԭ�� ��
��FeS�������ղ�����SO2����ͨ��������Һ�У��ܹ������������� ������ţ�
����������SO2����ͨ��0.2 mol��L��1��NaOH��Һ��������Һ�����ԣ�����Һ������Ũ���ɴ�С��˳��Ϊ ��
��2�����õ�ⷨ��������Cr2O72�������Է�ˮ���ڷ�ˮ�м�������NaCl�������缫���һ��ʱ�����Cr(OH)3��Fe(OH)3�������ɣ��Ӷ����ͷ�ˮ�и�Ԫ�صĺ�������������ʯī�缫���ܲ���Cr(OH)3�������ñ�Ҫ�Ļ�ѧ����˵��ԭ��___________________��
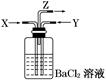
��3���ϰ�ˮ����ת���ɰ���������Ƴɼ���ȼ�ϵ�ء���ͼ�Ǹ�ȼ�ϵ��ʾ��ͼ��������X�����ֱ���ŷŵ������С�a�缫�� ���������������������������������缫��ӦʽΪ ��T���£�ij�о�Ա�ⶨNH3��H2O�ĵ��볣��Ϊ1.8��10��5��NH4+��ˮ��ƽ�ⳣ��Ϊ1.5��10��8��ˮ��ƽ��Ҳ��һ�ֻ�ѧƽ�⣬��ƽ�ⳣ����ˮ�ⳣ����������¶���ˮ�����ӻ�����Ϊ �����ж�T 25�棨���������������������

��1�����������ҵ��ˮ�г�����Cu2+���ؽ������ӣ�����FeS������������Ϊ��������ȥ����֪������Ksp(FeS)��6.3��10��18mol2��L��2��Ksp(CuS)��1.3��10��36mol2��L��2��
���������ӷ���ʽ˵���������ӵ�ԭ�� ��
��FeS�������ղ�����SO2����ͨ��������Һ�У��ܹ������������� ������ţ�
| A��Ba(NO3)2 | B��BaCl2 | C��Ba(OH)2 | D������NH3��BaCl2��Һ |
��2�����õ�ⷨ��������Cr2O72�������Է�ˮ���ڷ�ˮ�м�������NaCl�������缫���һ��ʱ�����Cr(OH)3��Fe(OH)3�������ɣ��Ӷ����ͷ�ˮ�и�Ԫ�صĺ�������������ʯī�缫���ܲ���Cr(OH)3�������ñ�Ҫ�Ļ�ѧ����˵��ԭ��___________________��
��3���ϰ�ˮ����ת���ɰ���������Ƴɼ���ȼ�ϵ�ء���ͼ�Ǹ�ȼ�ϵ��ʾ��ͼ��������X�����ֱ���ŷŵ������С�a�缫�� ���������������������������������缫��ӦʽΪ ��T���£�ij�о�Ա�ⶨNH3��H2O�ĵ��볣��Ϊ1.8��10��5��NH4+��ˮ��ƽ�ⳣ��Ϊ1.5��10��8��ˮ��ƽ��Ҳ��һ�ֻ�ѧƽ�⣬��ƽ�ⳣ����ˮ�ⳣ����������¶���ˮ�����ӻ�����Ϊ �����ж�T 25�棨���������������������

��1����FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+��aq��
��A C D
��c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)��
(2)��ΪFe�缫�ڵ������в�����ԭ�Ե�Fe2+������Һ��Cr2O72����ԭΪCr3+��Cr2O72����6Fe2+��14H+ ��2Cr3+��6Fe3+��7H2O��������ʯī�缫��������������Cl2�����ܽ�Cr2O72����ԭΪCr3+��
��3���� 2NH3+6OH����6e�� =N2+6H2O 2.7��10��13����
��A C D
��c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)��
(2)��ΪFe�缫�ڵ������в�����ԭ�Ե�Fe2+������Һ��Cr2O72����ԭΪCr3+��Cr2O72����6Fe2+��14H+ ��2Cr3+��6Fe3+��7H2O��������ʯī�缫��������������Cl2�����ܽ�Cr2O72����ԭΪCr3+��
��3���� 2NH3+6OH����6e�� =N2+6H2O 2.7��10��13����
���������(1) FeS�������ܣ�Ҳ��һ�����ܽ�ȣ�����Һ�д����ų����ܽ�ƽ�⣺FeS(s)
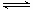 Fe2+(aq)+S2-(aq) ,����Ksp(FeS)��6.3��10��18mol2��L��2>>Ksp(CuS)��1.3��10��36mol2��L��2�����Ե���Һ�к���Cu2+ʱ��Cu2+�ͻ���FeS���������S2-��ϲ��������ܵij���CuS��Cu2++ S2-=CuS����FeS���ܽ���룬������S2-�ٷ�Ӧ��ΪCuS�����������ܹ�����Һ�е�Cu2+��ȫ������ȥ����Ӧ�����ַ���ʽΪ����FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+( aq). �� SO2+H2O=H2SO3,��Һ�����ԡ�A���������м���Ba(NO3)2ʱ��Ҳ���൱�ڴ������ᡣ������ǿ�����ԣ��ܰ�H2SO3��������H2SO4.�ʻ����BaSO4��������ȷ��B����������BaCl2������Ӧ����Ӧ�ķ���ʽΪ��B��BaCl2+ SO2+H2O=BaSO3��+2HCl. BaSO3����HCl������Ӧ�����������Ի��������ڡ����÷�Ӧ�Dz��ܷ����ġ����仰˵���Dz��ܷ�����Ӧ����������C������������SO2��������Ӧ��Ba(OH)2+ SO2=BaSO3��+ H2O.��ȷ��D�����ȷ�����Ӧ��2NH3+ SO2+H2O= (NH4)2SO3,Ȼ������(NH4)2SO3+BaCl2= BaSO3��+ 2NH4Cl .��ȷ�����ѡ��ΪA��C��D��������SO2���������Է�Ӧ�ķ���ʽΪ��SO2+NaOH=NaHSO3��NaHSO3=Na++HSO3-��HSO3-����Һ�д��ڵ���ƽ��HSO3-
Fe2+(aq)+S2-(aq) ,����Ksp(FeS)��6.3��10��18mol2��L��2>>Ksp(CuS)��1.3��10��36mol2��L��2�����Ե���Һ�к���Cu2+ʱ��Cu2+�ͻ���FeS���������S2-��ϲ��������ܵij���CuS��Cu2++ S2-=CuS����FeS���ܽ���룬������S2-�ٷ�Ӧ��ΪCuS�����������ܹ�����Һ�е�Cu2+��ȫ������ȥ����Ӧ�����ַ���ʽΪ����FeS(s)+Cu2+(aq)=" CuS(s)+" Fe 2+( aq). �� SO2+H2O=H2SO3,��Һ�����ԡ�A���������м���Ba(NO3)2ʱ��Ҳ���൱�ڴ������ᡣ������ǿ�����ԣ��ܰ�H2SO3��������H2SO4.�ʻ����BaSO4��������ȷ��B����������BaCl2������Ӧ����Ӧ�ķ���ʽΪ��B��BaCl2+ SO2+H2O=BaSO3��+2HCl. BaSO3����HCl������Ӧ�����������Ի��������ڡ����÷�Ӧ�Dz��ܷ����ġ����仰˵���Dz��ܷ�����Ӧ����������C������������SO2��������Ӧ��Ba(OH)2+ SO2=BaSO3��+ H2O.��ȷ��D�����ȷ�����Ӧ��2NH3+ SO2+H2O= (NH4)2SO3,Ȼ������(NH4)2SO3+BaCl2= BaSO3��+ 2NH4Cl .��ȷ�����ѡ��ΪA��C��D��������SO2���������Է�Ӧ�ķ���ʽΪ��SO2+NaOH=NaHSO3��NaHSO3=Na++HSO3-��HSO3-����Һ�д��ڵ���ƽ��HSO3-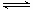 H++SO32-��ˮ��ƽ��HSO3-+ H2O
H++SO32-��ˮ��ƽ��HSO3-+ H2O 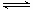 H2SO3+OH-������ʹ��Һ�����ԣ�ˮ��ʹ��Һ�Լ��ԡ���Ϊ������Һ�����ԣ����Ե������ˮ�⡣c (H+)>c(OH-).����Һ�г��˴���ˮ��ƽ�������H2O
H2SO3+OH-������ʹ��Һ�����ԣ�ˮ��ʹ��Һ�Լ��ԡ���Ϊ������Һ�����ԣ����Ե������ˮ�⡣c (H+)>c(OH-).����Һ�г��˴���ˮ��ƽ�������H2O 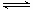 H++OH-��SO32-ֻ��HSO3-�������������c (H+)>c(SO32-)������ʵĵ���̶ȣ�HSO3-> H2O�����c(SO32-)> c(OH-)������HSO3-�ǵ��뻹��ˮ�ⶼҪ���ģ�����c(Na+)>c(HSO3-).�����Һ�и������ӵ�Ũ�ȹ�ϵΪ��c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)��(2) �����缫���һ��ʱ��� Fe(OH)3�������ɣ�˵��Fe���Դ�����������ӣ�������,������������ԭ��Ӧ��Fe-2e-=Fe2+.������Fe2+�л�ԭ�ԣ��ܽ���Һ��Cr2O72����ԭΪCr3+�����߷����ķ�ӦΪ��Cr2O72����6Fe2+��14H+ ��2Cr3+��6Fe3+��7H2O��Cr3+��Fe3+ˮ�����Cr(OH)3��Fe(OH)3�������Ӷ����Խ��ͷ�ˮ�и�Ԫ�صĺ�������������ʯī�缫����缫�������μӷ�Ӧ������Һ�е�Cl-ʧȥ���ӡ���������������Cl2���Ͳ��ܽ�Cr2O72����ԭΪCr3+����3������Ƴɼ���ȼ�ϵ�أ�������X�����ֱ���ŷŵ������С���XΪN2,a�缫���������缫��ӦΪ2NH3+6OH����6e�� =N2+6H2O��ͨ������ĵ缫Ϊ������������Ӧ��O2+4e-+2H2O=4OH-��NH3��H2O
H++OH-��SO32-ֻ��HSO3-�������������c (H+)>c(SO32-)������ʵĵ���̶ȣ�HSO3-> H2O�����c(SO32-)> c(OH-)������HSO3-�ǵ��뻹��ˮ�ⶼҪ���ģ�����c(Na+)>c(HSO3-).�����Һ�и������ӵ�Ũ�ȹ�ϵΪ��c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)��(2) �����缫���һ��ʱ��� Fe(OH)3�������ɣ�˵��Fe���Դ�����������ӣ�������,������������ԭ��Ӧ��Fe-2e-=Fe2+.������Fe2+�л�ԭ�ԣ��ܽ���Һ��Cr2O72����ԭΪCr3+�����߷����ķ�ӦΪ��Cr2O72����6Fe2+��14H+ ��2Cr3+��6Fe3+��7H2O��Cr3+��Fe3+ˮ�����Cr(OH)3��Fe(OH)3�������Ӷ����Խ��ͷ�ˮ�и�Ԫ�صĺ�������������ʯī�缫����缫�������μӷ�Ӧ������Һ�е�Cl-ʧȥ���ӡ���������������Cl2���Ͳ��ܽ�Cr2O72����ԭΪCr3+����3������Ƴɼ���ȼ�ϵ�أ�������X�����ֱ���ŷŵ������С���XΪN2,a�缫���������缫��ӦΪ2NH3+6OH����6e�� =N2+6H2O��ͨ������ĵ缫Ϊ������������Ӧ��O2+4e-+2H2O=4OH-��NH3��H2O 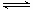 NH4++OH-��
NH4++OH-�� 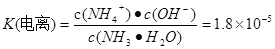 - NH4++ H2O
- NH4++ H2O 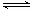 H+ + NH3��H2O,
H+ + NH3��H2O, 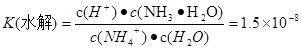 .����ʽ��ˣ��ɵ�
.����ʽ��ˣ��ɵ�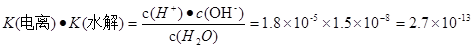 ��c (H+)��c(OH-)=K(����) ��K(ˮ��) ��c(H2O)="Kw." �����ڸ��¶���ˮ�����ӻ�����Kw=2.7��10-13.ˮ��������ʣ������¶ȣ��ٽ�ˮ�ĵ��룬ˮ�������������Ũ������ˮ�����ӻ�����Ҳ��������2.7��10-13>1.0��10-14.�����¶ȸ���25�档2�ij�ȥ����������Cr2O72�������Է�ˮ�ĵ�ⷨ������ԭ��صķ�Ӧԭ�����缫ʽ����д��������ʵĵ���ƽ�⡢�ε�ˮ��ƽ�⡢ˮ�����ӻ������ļ����֪ʶ��
��c (H+)��c(OH-)=K(����) ��K(ˮ��) ��c(H2O)="Kw." �����ڸ��¶���ˮ�����ӻ�����Kw=2.7��10-13.ˮ��������ʣ������¶ȣ��ٽ�ˮ�ĵ��룬ˮ�������������Ũ������ˮ�����ӻ�����Ҳ��������2.7��10-13>1.0��10-14.�����¶ȸ���25�档2�ij�ȥ����������Cr2O72�������Է�ˮ�ĵ�ⷨ������ԭ��صķ�Ӧԭ�����缫ʽ����д��������ʵĵ���ƽ�⡢�ε�ˮ��ƽ�⡢ˮ�����ӻ������ļ����֪ʶ��
��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
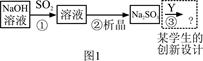
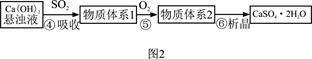
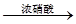 H2SO4
H2SO4
 H2SO3
H2SO3 2SO3
2SO3
 O2
O2
