网址:http://m.1010jiajiao.com/timu_id_5194[举报]
(一)选择题
1.BC2.B3.C.4.C5.C6.C7.B8.C9.BD10.AC11.BD12.D13.B14.C15.D.16.BC17.C18.B19.CD20.CD21.C22.D23.A24.CD25.A26.B27.C28.CD29.B30.A31.C32.(1)D(2)C33.C34.BC35.C36.D37.C38.D39.D40.B、C
(二)非选择题
1.(1)选用AgNO3溶液较好(CuSO4溶液次之,NaCl和H2SO4溶液更次之),①若电解NaCl、H2SO4溶液,产生的气体体积较难测定准确;②同样条件下,通过等量的电量,析出的Ag的质量大于Cu,因而称量和计算时产生的误差前者要小
(2)①电流强度;②电解(通电)时间;③电解产物的质量
(3)NA=
I:电流强度;t:通时间;mAg:析出银的质量MAg:Ag的摩尔质量。
2.(1)BH+2H2O4H2↑+BO―2
(2)pH愈小,反应速率愈大(3)1、16、8、7、4、7
3.DG+CO2M(D)==100D为MCO3,则M(M)=100-60=40M为Ca2+,A为Ca2+盐〔可溶性含氧酸钙盐可能为Ca(NO3)2〕,B为碳酸盐(可溶性碳酸盐有K+、Na+、NH+4……)
从EF+H2O,而F为非金属氧化物,则E含H、O及另一非金属,可推测E为NH4NO3
又:M(F)×+18×M(F)=44,氮的氧化物中N2O相对分子质量为44,和题意相符,可推得A:Ca(NO3)2、B:(NH4)2CO3、D:CaCO3、E:NH4NO3、F:N2O
4.13P4+10P2I4+128H2O32H3PO4+40PH4I
5.5、8、12、10、4、8、12;紫红色溶液褪去;不能用,因为KMnO4与HCl反应,HNO3的氧化性会干扰KMnO4的氧化性。
6.(1)2、5-n、2n、2、5-n、n+3(2)2、+6(3)B、C
7.(1)31.6,36.8,42.1(2)1.58×1024?(3)58.95L/mol(4)42.1g
8.(1)CO;(2)HF;(3)C+H2OCO+H2;(4)2F2+2H2O4HF+O2
9.(1)1cm3中阴、阳离子总数=
1cm3中Ni2+-O2-离子对数=
密度=
(2)设1molNi0.97O中含Ni3+xmol,Ni2+(0.97-x)mol,根据电中性;3xmol+2(0.97-x)mol=2×1mol,x=0.06
Ni2+为(0.97-x)mol=0.91mol
离子数之比Ni3+∶Ni2+=0.06∶0.91=6∶91
10.(1)1∶4;(2)0.12mol;(3)60%
11.(1)1∶50,增大O2量,平衡正向移动,提高SO2转化率(2)保证NH3∶SO2=2∶1(3)3.54t,0.912t.
12.(1)25%(2)2a(3)6(4)n>m
13.(1)BiCl3+H2OBiOCl↓+2HCl(2)不同意,因BiOCl中Cl为-1价而不是+1价。(3)将BiCl3溶解于含适量HCl的蒸馏水中(4)增大溶液中Cl―浓度,抑制BiCl3的水解。
14.(1)NH+Al3++2SO+2Ba2++4OH―2BaSO4↓+Al(OH)3↓+NH3↑+H2O
(2)Al(OH)3+OH―AlO+2H2O
15.(1)HCO+Br2HBrO+Br―+CO2↑
(2)2CO+Br2+H2O2HCO+Br―+BrO―
16.(1)该条件下D的密度ag/L;19.5+11.0-3.00L×ag/L;
(2)盐酸的物质的量浓度bmol/L;当×2≤0.01×b时,盐酸足量:V(H2)=×22.4L
当×2>0.01×b时,盐酸不足:V(H2)=×0.01×b×22.4L。
17.(1)CH3COOHCH3COO―+H+,CH3COO―+H2OCH3COOH+OH―,H2OH++OH―
18.(1)DABF→B→A→C→D→E
(2)2Cl―-2eCl2↑变蓝色Cl2+2I―2Cl―+I2
(3)①③④⑥(4)NA=
19.(1)
(2)N2+O22NO
112
说明氧气过量,过量2体积,根据NO和O2的反应
2NO+O2=2NO
212
说明反应后所得气体NO22体积,O21体积。故密闭容器中气体的体积为3体积。所以
(3)减少,不变。
20.A:NaOHB:NaNO3C:Ba(NO3)2D:HNO3X:MgSO4
①原混合气体的体积为
②反应达到平衡时,气体A消耗了
③反应达到平衡后,气体B消耗了
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
(1)从反应开始到第10min,氢气的平均反应速率v(H2)=______,在这段时间内,反应放出的热量=______.
(2)在该条件下,反应的平衡常数K的值=______(保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡______(填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______(填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入1mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
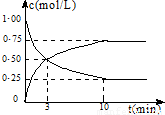
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
(1)从反应开始到第10min,氢气的平均反应速率v(H2)=______,在这段时间内,反应放出的热量=______.
(2)在该条件下,反应的平衡常数K的值=______(保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡______(填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______(填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入1mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
(1)从反应开始到第10min,氢气的平均反应速率v(H2)=______,在这段时间内,反应放出的热量=______.
(2)在该条件下,反应的平衡常数K的值=______(保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡______(填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______(填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入1mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容
器中,发生反应:2SO2+O2 ![]() 2SO3(正反应放热)。达到平衡后,将容器中的混
2SO3(正反应放热)。达到平衡后,将容器中的混
合气体通过过量NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过某溶液吸收
O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留
一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是_______。(填字母)
a.SO2和SO3浓度相等 b.SO2百分含量保持不变
c.容器中气体的压强不变 d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是_______。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2
c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO3的转化率_______(用百分数表示)。
查看习题详情和答案>>