网址:http://m.1010jiajiao.com/timu_id_515669[举报]
第I卷(共126分)
一、选择题(78分)
1.B 2.C 3.D 4.A 5.D 6.B 7.C 8.A 9.D 10.B 11.D
12.A 13.C
二、选择题(48分)
14.A 15.C 16.D 17.C 18.BD 19.CD 20.B 21.AC
第Ⅱ卷(共174分)
.files/image271.jpg) 22.(17分)
22.(17分)
(1)①BCD全对得2分,对而不全得1分,有错不得分。
②.files/image273.gif) 3分
3分
(2)①如图1所示 2分
②B E D 每空2分, 共6分
③.files/image275.gif) 2分
2分 .files/image277.gif) 2分
2分
23.(16分)解:(1)设两人奔跑的最大速度为.files/image279.gif) ,乙在接力区跑出的距离为
,乙在接力区跑出的距离为.files/image281.gif) 时速度达到
时速度达到.files/image283.gif) ,根据运动学公式有
,根据运动学公式有.files/image285.gif) 2分
2分
.files/image287.gif) 2分
2分
解得.files/image289.gif) 3分
3分
(2)设乙在距甲.files/image291.gif) 处开始起跑,到乙接棒时乙跑过的距离为
处开始起跑,到乙接棒时乙跑过的距离为.files/image281.gif)
根据运动学公式有.files/image294.gif) 2分
2分
.files/image296.gif) 2分
2分
且.files/image298.gif) 2分
2分
解得.files/image300.gif) 3分
3分
24.(19分)解:粒子在点场中做类平抛运动,有.files/image302.gif) 设
设.files/image134.gif) 两点间电势差为
两点间电势差为.files/image305.gif) ,由动能定理有
,由动能定理有
.files/image307.gif) 3分
3分
解得:.files/image309.gif) 2分
2分
(2)粒子在.files/image311.gif) 的区域内运动的轨迹如图2所示。设其在匀强磁场中做匀速圆周运动的轨道半径为
的区域内运动的轨迹如图2所示。设其在匀强磁场中做匀速圆周运动的轨道半径为.files/image313.gif) ,磁场的磁感应强度为
,磁场的磁感应强度为.files/image315.gif) 。由题意,粒子做圆周运动的圆心一定在
。由题意,粒子做圆周运动的圆心一定在.files/image223.gif) 轴上
轴上
.files/image318.jpg) 由牛顿第二定律
由牛顿第二定律.files/image320.gif) 2分
2分
解得.files/image322.gif) 1分
1分
由几何知道得.files/image324.gif) 1分
1分
解得.files/image326.gif) 1分
1分
所以.files/image328.gif) 2分
2分
(3)由题意,当以粒子进入磁场的位置和射出磁场的位置的连线作为磁场的直径时,磁场面积最小 1分
设磁场的最小面积为.files/image330.gif)
由几何知道得磁场面积最小时的半径.files/image332.gif) 2分
2分
解得最小面积为.files/image334.gif)
.files/image335.jpg) 25.(20分)解:(1)金属棒在图3所示各力作用下,先做加速度逐渐减小的加速运动,当加速度为零时,金属棒达到最大速度,此后开始做匀速直线运动。设最大速度为
25.(20分)解:(1)金属棒在图3所示各力作用下,先做加速度逐渐减小的加速运动,当加速度为零时,金属棒达到最大速度,此后开始做匀速直线运动。设最大速度为.files/image337.gif) ,金属棒达到最大速度的一半时的加速度为
,金属棒达到最大速度的一半时的加速度为.files/image095.gif)
.files/image340.jpg) 则速度达到最大时有
则速度达到最大时有.files/image342.gif) 1分
1分
.files/image344.gif) 1分
1分
.files/image346.gif) 1分
1分
由以上各式解得 .files/image348.gif) 1分
1分
金属棒达到最大速度的一半时,由牛顿第二定律有
.files/image350.gif) 2分
2分
.files/image352.gif)
解得.files/image354.gif) 1分
1分
(2)设整个电路放出的电热为.files/image146.gif) ,由能量守恒定律有
,由能量守恒定律有
.files/image357.gif) 2分
2分
代入上面的.files/image337.gif) 值,可得
值,可得.files/image360.gif) 1分
1分
因.files/image362.gif)
故金属棒放出的电热.files/image364.gif) 2分
2分
(3).files/image366.gif) 上消耗的功率
上消耗的功率.files/image368.gif) 1分
1分
.files/image370.gif)
.files/image372.gif)
.files/image374.gif) 3分
3分
.files/image376.gif) 1分
1分
当.files/image378.gif) 时
1分
时
1分
.files/image366.gif) 消耗的功率最大
消耗的功率最大 .files/image381.gif) 2分
2分
26.(13分)
(1).files/image223.gif) 的电子式:
的电子式:.files/image384.jpg) 2分 非极性1分
2分 非极性1分
(2)87 1分
(3)C 1分
(4)碱(1分) .files/image386.gif) 2分
2分
.files/image388.gif) 2分
2分
(5).files/image390.gif) 2分 减小1分
2分 减小1分
.files/image392.jpg) 27.(16分)
27.(16分)
(1).files/image394.gif) (2分)
1分
(2分)
1分
(2)①⑥(各1分,共2分。答③不扣分,其余有错扣1分)
(3)羟基1分 羧基1分
.files/image396.jpg)
.files/image398.jpg)
.files/image400.jpg)
28.(16分)
(1).files/image402.gif) 2分 沸腾炉1分
2分 沸腾炉1分
(2)氯酸钾 (或.files/image404.gif) ) 1分 镁条(或
) 1分 镁条(或.files/image406.gif) ) 1分
) 1分
(3).files/image408.gif) 2分
2分
防止产生的.files/image234.gif) 和
和.files/image059.gif) 混和发生爆炸 1分 ,避免
混和发生爆炸 1分 ,避免.files/image234.gif) 和
和.files/image413.gif) 反应,使生成的
反应,使生成的.files/image413.gif) 不纯1分
不纯1分
(4).files/image416.gif) 2分
2分
(5)I.不合理(1分),该反应为放热反应,升高温度会降低.files/image243.gif) 的产率,但温度过低,
的产率,但温度过低,
反应速率很小,经济效益较低。因此,应选择适当的温度。(2分)
29.(15分)
(1)增大铜粉与氧接触面积,使反应迅速、充分(2分)
(2).files/image419.gif) (1分) 排出D中的空气(1分) 关闭
(1分) 排出D中的空气(1分) 关闭.files/image256.gif) (1分) 打开
(1分) 打开.files/image422.gif) (1分)
(1分)
(3)锥形瓶中玻璃管液面上升(1分)
(4).files/image424.gif) (2分)
(2分)
(5)向下调节量气管(或及时关闭.files/image256.gif) ) (1分,其他合理答案也可给分)
) (1分,其他合理答案也可给分)
(6)I.0.0720.files/image427.gif) (2分)
(2分)
Ⅱ.有(1分) E装置中生成100mL、0.0720 .files/image427.gif) 硝酸时产生的
硝酸时产生的.files/image429.gif) 约为80.6mL,而
约为80.6mL,而
试管中原有50mL.files/image419.gif) ,二者之和小于139.00mL,说明生成
,二者之和小于139.00mL,说明生成.files/image432.gif) 的同时有NO生成(2分)
的同时有NO生成(2分)
30.(24分)I(8分,每空2分)
J 天敌 竞争 抵抗力
Ⅱ(16分)
(1)原因:肝细胞利用保存液中葡萄糖有氧呼吸(2分),线粒子体产生的.files/image267.gif) 扩散进入细
扩散进入细
胞质基质中。(1分)改进措施:用不含葡萄糖的保存液(2分)
(2)胰蛋白(2分) (3)结构的完整性(2分)
(4)丙铜酸进一步分解的产物有.files/image267.gif) (2分),检验是否有
(2分),检验是否有.files/image267.gif) 产生可判断丙铜酸是否被
产生可判断丙铜酸是否被
分解。(2分)
(5)分别给1号和2号试管设空白对照组1’和2’,(1分) 1’和2’试管所装物质分
别与1号和2号相同,只是下一步不加入丙铜酸(1分),而加入生理盐水。(1分)
31.(18分)(除(2)②小题每空3分外,其余每空2分)
(1)①.files/image437.gif) ②
②.files/image439.gif) ③
③.files/image441.gif)
(2)①雄鸡全为芦花,雌鸡全为非芦花 ②雌鸡全为芦花,雄鸡有芦花与非芦花两中雌鸡
和雄鸡均有芦花与非芦花两种
(3).files/image443.gif) 在雏鸡阶段淘汰绒羽为黑色且头顶有黄
在雏鸡阶段淘汰绒羽为黑色且头顶有黄
色斑点的个体,其于个体全部保留饲养
.files/image445.gif) www.ks5u.com
www.ks5u.com
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
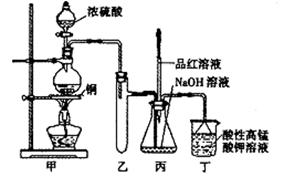
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量 次。
②下面是其中一次实验的数据
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”或“偏小”)。
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
查看习题详情和答案>>(14分)实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:

请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量 次。
②下面是其中一次实验的数据
|
坩埚质量 |
坩埚与晶体总质量 |
加热后坩埚与固体总质量 |
|
11.7g |
22.7g |
18.6g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”或“偏小”)。
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
查看习题详情和答案>>
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。

(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有 ???????? 。
(2)反应后在装置C中可得NaClO2溶液。已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上右图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤: ① 蒸发结晶;② ??????????? ;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:① 准确量取ClO2溶液V1mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0。② 加入足量的KI晶体,静置片刻。此时发生反应的离子方程式为:????????????? ;③ 加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为????????? mol/L(用含字母的代数式表示)。(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
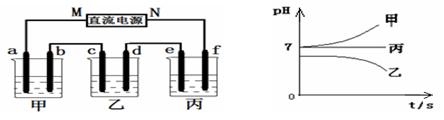
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl- 组合形成的三种强电解质溶液,分别装入下图装置
中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。

接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式?????????????????????????????????????? ;
(2)电极f上发生的电极反应为????????????????????????????? ;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是??????????????????????????????????? 。
查看习题详情和答案>>
Ⅰ.二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用稍潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示装置模拟工业制取并收集ClO2。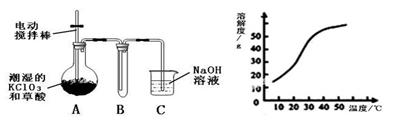
(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有 。
(2)反应后在装置C中可得NaClO2溶液。已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上右图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤: ① 蒸发结晶;② ;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:① 准确量取ClO2溶液V1mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0。② 加入足量的KI晶体,静置片刻。此时发生反应的离子方程式为: ;③ 加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为 mol/L(用含字母的代数式表示)。(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl- 组合形成的三种强电解质溶液,分别装入下图装置
中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。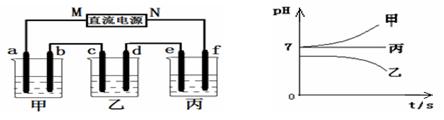
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式 ;
(2)电极f上发生的电极反应为 ;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是 。
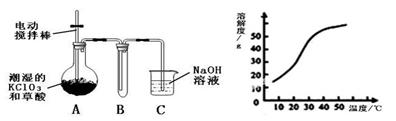
(1)A必须添加温度控制装置,除酒精灯、温度计外,还需要的玻璃仪器有 。
(2)反应后在装置C中可得NaClO2溶液。已知在温度低于38℃时NaClO2饱和溶液中析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据上右图所示的NaClO2的溶解度曲线,请补充从NaClO2溶液中制得NaClO2晶体的操作步骤: ① 蒸发结晶;② ;③ 洗涤;④ 干燥。
(3)ClO2很不稳定,需随用随制,用水吸收得到ClO2溶液。为测定所得溶液中ClO2的浓度,进行了下列实验:① 准确量取ClO2溶液V1mL加入到锥形瓶中,加适量蒸馏水稀释,调节试样的pH≤2.0。② 加入足量的KI晶体,静置片刻。此时发生反应的离子方程式为: ;③ 加入淀粉指示剂,用c mol/L Na2S2O3溶液滴定,至终点时消耗Na2S2O3溶液V2 mL。则原ClO2溶液的浓度为 mol/L(用含字母的代数式表示)。(已知2 Na2S2O3+I2= Na2S4O6+2NaI)
Ⅱ.将由Na+、Ba2+、Cu2+、SO42-、Cl- 组合形成的三种强电解质溶液,分别装入下图装置
中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题:
(1)写出乙烧杯中发生反应的化学方程式 ;
(2)电极f上发生的电极反应为 ;
(3)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是 。