网址:http://m.1010jiajiao.com/timu_id_515588[举报]
第I卷(共126分)
一、选择题(78分)
1.B 2.C 3.D 4.A 5.D 6.B 7.C 8.A 9.D 10.B 11.D
12.A 13.C
二、选择题(48分)
14.A 15.C 16.D 17.C 18.BD 19.CD 20.B 21.AC
第Ⅱ卷(共174分)
.files/image271.jpg) 22.(17分)
22.(17分)
(1)①BCD全对得2分,对而不全得1分,有错不得分。
②.files/image273.gif) 3分
3分
(2)①如图1所示 2分
②B E D 每空2分, 共6分
③.files/image275.gif) 2分
2分 .files/image277.gif) 2分
2分
23.(16分)解:(1)设两人奔跑的最大速度为.files/image279.gif) ,乙在接力区跑出的距离为
,乙在接力区跑出的距离为.files/image281.gif) 时速度达到
时速度达到.files/image283.gif) ,根据运动学公式有
,根据运动学公式有.files/image285.gif) 2分
2分
.files/image287.gif) 2分
2分
解得.files/image289.gif) 3分
3分
(2)设乙在距甲.files/image291.gif) 处开始起跑,到乙接棒时乙跑过的距离为
处开始起跑,到乙接棒时乙跑过的距离为.files/image281.gif)
根据运动学公式有.files/image294.gif) 2分
2分
.files/image296.gif) 2分
2分
且.files/image298.gif) 2分
2分
解得.files/image300.gif) 3分
3分
24.(19分)解:粒子在点场中做类平抛运动,有.files/image302.gif) 设
设.files/image134.gif) 两点间电势差为
两点间电势差为.files/image305.gif) ,由动能定理有
,由动能定理有
.files/image307.gif) 3分
3分
解得:.files/image309.gif) 2分
2分
(2)粒子在.files/image311.gif) 的区域内运动的轨迹如图2所示。设其在匀强磁场中做匀速圆周运动的轨道半径为
的区域内运动的轨迹如图2所示。设其在匀强磁场中做匀速圆周运动的轨道半径为.files/image313.gif) ,磁场的磁感应强度为
,磁场的磁感应强度为.files/image315.gif) 。由题意,粒子做圆周运动的圆心一定在
。由题意,粒子做圆周运动的圆心一定在.files/image223.gif) 轴上
轴上
.files/image318.jpg) 由牛顿第二定律
由牛顿第二定律.files/image320.gif) 2分
2分
解得.files/image322.gif) 1分
1分
由几何知道得.files/image324.gif) 1分
1分
解得.files/image326.gif) 1分
1分
所以.files/image328.gif) 2分
2分
(3)由题意,当以粒子进入磁场的位置和射出磁场的位置的连线作为磁场的直径时,磁场面积最小 1分
设磁场的最小面积为.files/image330.gif)
由几何知道得磁场面积最小时的半径.files/image332.gif) 2分
2分
解得最小面积为.files/image334.gif)
.files/image335.jpg) 25.(20分)解:(1)金属棒在图3所示各力作用下,先做加速度逐渐减小的加速运动,当加速度为零时,金属棒达到最大速度,此后开始做匀速直线运动。设最大速度为
25.(20分)解:(1)金属棒在图3所示各力作用下,先做加速度逐渐减小的加速运动,当加速度为零时,金属棒达到最大速度,此后开始做匀速直线运动。设最大速度为.files/image337.gif) ,金属棒达到最大速度的一半时的加速度为
,金属棒达到最大速度的一半时的加速度为.files/image095.gif)
.files/image340.jpg) 则速度达到最大时有
则速度达到最大时有.files/image342.gif) 1分
1分
.files/image344.gif) 1分
1分
.files/image346.gif) 1分
1分
由以上各式解得 .files/image348.gif) 1分
1分
金属棒达到最大速度的一半时,由牛顿第二定律有
.files/image350.gif) 2分
2分
.files/image352.gif)
解得.files/image354.gif) 1分
1分
(2)设整个电路放出的电热为.files/image146.gif) ,由能量守恒定律有
,由能量守恒定律有
.files/image357.gif) 2分
2分
代入上面的.files/image337.gif) 值,可得
值,可得.files/image360.gif) 1分
1分
因.files/image362.gif)
故金属棒放出的电热.files/image364.gif) 2分
2分
(3).files/image366.gif) 上消耗的功率
上消耗的功率.files/image368.gif) 1分
1分
.files/image370.gif)
.files/image372.gif)
.files/image374.gif) 3分
3分
.files/image376.gif) 1分
1分
当.files/image378.gif) 时
1分
时
1分
.files/image366.gif) 消耗的功率最大
消耗的功率最大 .files/image381.gif) 2分
2分
26.(13分)
(1).files/image223.gif) 的电子式:
的电子式:.files/image384.jpg) 2分 非极性1分
2分 非极性1分
(2)87 1分
(3)C 1分
(4)碱(1分) .files/image386.gif) 2分
2分
.files/image388.gif) 2分
2分
(5).files/image390.gif) 2分 减小1分
2分 减小1分
.files/image392.jpg) 27.(16分)
27.(16分)
(1).files/image394.gif) (2分)
1分
(2分)
1分
(2)①⑥(各1分,共2分。答③不扣分,其余有错扣1分)
(3)羟基1分 羧基1分
.files/image396.jpg)
.files/image398.jpg)
.files/image400.jpg)
28.(16分)
(1).files/image402.gif) 2分 沸腾炉1分
2分 沸腾炉1分
(2)氯酸钾 (或.files/image404.gif) ) 1分 镁条(或
) 1分 镁条(或.files/image406.gif) ) 1分
) 1分
(3).files/image408.gif) 2分
2分
防止产生的.files/image234.gif) 和
和.files/image059.gif) 混和发生爆炸 1分 ,避免
混和发生爆炸 1分 ,避免.files/image234.gif) 和
和.files/image413.gif) 反应,使生成的
反应,使生成的.files/image413.gif) 不纯1分
不纯1分
(4).files/image416.gif) 2分
2分
(5)I.不合理(1分),该反应为放热反应,升高温度会降低.files/image243.gif) 的产率,但温度过低,
的产率,但温度过低,
反应速率很小,经济效益较低。因此,应选择适当的温度。(2分)
29.(15分)
(1)增大铜粉与氧接触面积,使反应迅速、充分(2分)
(2).files/image419.gif) (1分) 排出D中的空气(1分) 关闭
(1分) 排出D中的空气(1分) 关闭.files/image256.gif) (1分) 打开
(1分) 打开.files/image422.gif) (1分)
(1分)
(3)锥形瓶中玻璃管液面上升(1分)
(4).files/image424.gif) (2分)
(2分)
(5)向下调节量气管(或及时关闭.files/image256.gif) ) (1分,其他合理答案也可给分)
) (1分,其他合理答案也可给分)
(6)I.0.0720.files/image427.gif) (2分)
(2分)
Ⅱ.有(1分) E装置中生成100mL、0.0720 .files/image427.gif) 硝酸时产生的
硝酸时产生的.files/image429.gif) 约为80.6mL,而
约为80.6mL,而
试管中原有50mL.files/image419.gif) ,二者之和小于139.00mL,说明生成
,二者之和小于139.00mL,说明生成.files/image432.gif) 的同时有NO生成(2分)
的同时有NO生成(2分)
30.(24分)I(8分,每空2分)
J 天敌 竞争 抵抗力
Ⅱ(16分)
(1)原因:肝细胞利用保存液中葡萄糖有氧呼吸(2分),线粒子体产生的.files/image267.gif) 扩散进入细
扩散进入细
胞质基质中。(1分)改进措施:用不含葡萄糖的保存液(2分)
(2)胰蛋白(2分) (3)结构的完整性(2分)
(4)丙铜酸进一步分解的产物有.files/image267.gif) (2分),检验是否有
(2分),检验是否有.files/image267.gif) 产生可判断丙铜酸是否被
产生可判断丙铜酸是否被
分解。(2分)
(5)分别给1号和2号试管设空白对照组1’和2’,(1分) 1’和2’试管所装物质分
别与1号和2号相同,只是下一步不加入丙铜酸(1分),而加入生理盐水。(1分)
31.(18分)(除(2)②小题每空3分外,其余每空2分)
(1)①.files/image437.gif) ②
②.files/image439.gif) ③
③.files/image441.gif)
(2)①雄鸡全为芦花,雌鸡全为非芦花 ②雌鸡全为芦花,雄鸡有芦花与非芦花两中雌鸡
和雄鸡均有芦花与非芦花两种
(3).files/image443.gif) 在雏鸡阶段淘汰绒羽为黑色且头顶有黄
在雏鸡阶段淘汰绒羽为黑色且头顶有黄
色斑点的个体,其于个体全部保留饲养
.files/image445.gif) www.ks5u.com
www.ks5u.com
下列说法中不正确的是![]()
![]()
![]() A.仅由共价键构成的物质不一定是共价化合物
A.仅由共价键构成的物质不一定是共价化合物
![]() B.含有离子键的化合物一定是离子化合物
B.含有离子键的化合物一定是离子化合物
![]() C.所有非金属氧化物在固态时都是分子晶体
C.所有非金属氧化物在固态时都是分子晶体
![]() D.离子晶体、原子晶体熔化时都破坏化学键,分子晶体熔化时为破坏化学键
D.离子晶体、原子晶体熔化时都破坏化学键,分子晶体熔化时为破坏化学键
开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。

①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K=??????? ;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA???? tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH 的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是:???????????????????????????????????? 。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。

①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是????????? ? ,曲线Ⅱ对应的实验条件改变是??????? 。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]

①下列说法中正确的是????? 。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ) =10ˉ1 mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是????? (填晶体类型)。
查看习题详情和答案>>
开发新能源和三废处理都是可持续发展的重要方面。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K= ;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: 。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]
①下列说法中正确的是 。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ) =10ˉ1 mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是 (填晶体类型)。
(1)由碳的氧化物直接合成乙醇燃料已进入大规模生产。如采取以CO和H2为原料合成乙醇,化学反应方程式:2CO(g)+4H2(g)
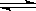 CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。
CH3CH2OH(g)+H2O(g);若密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成乙醇:CO的转化率(α)与温度、压强的关系如下图所示。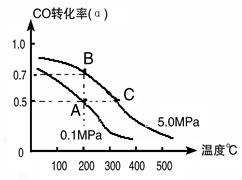
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数:K= ;
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
③工业上还可以采取以CO2和H2为原料合成乙醇,并且更被化学工作者推崇,但是在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。请推测化学工作者认可由CO2制取CH3CH2OH的优点主要是: 。
(2)目前工业上也可以用CO2来生产甲醇。一定条件下发生反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。
CH3OH(g)+H2O(g)。若将6mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化的曲线如右图所示(实线)。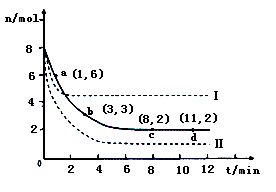
①请在答题卷图中绘出甲醇的物质的量随时间变化曲线。
②仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅱ对应的实验条件改变是 。
(3)Hg是水体污染的重金属元素之一。水溶液中二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-1gc(Clˉ)]
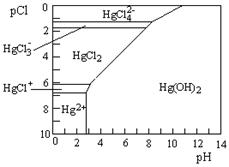
①下列说法中正确的是 。
A.为了防止Hg2+水解,配制Hg(NO3)2溶液时应将Hg(NO3)2固体溶于浓硝酸后再稀释
B.当c(C1ˉ) =10ˉ1 mol·Lˉ1时,汞元素一定全部以HgCl42ˉ形式存在
C.HgCl2是一种弱电解质,其电离方程式是:HgCl2=HgCl+ + C1ˉ
D.当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2
②HgCl2又称“升汞”,熔点549K,加热能升华,其晶体是 (填晶体类型)。