网址:http://m.1010jiajiao.com/timu_id_502973[举报]
一、选择题(每小题6分,共78分)
1
2
3
4
5
6
7
8
9
10
11
12
13
B
C
D
C
B
B
B
A
A
C
D
D
B
二、选择题(全部选对的给6分,选对但不全的给3分,有选错的给0分。共48分)
题号
14
15
16
17
18
19
20
21
答案
B
B
AD
B
CD
A
B
D
22、(1)×10(填“×10或×
换挡后未进行电阻调零,读出的欧姆表示数未乘以倍率 4分
(2)电源内阻较小且滑线变阻器阻值较大 4分
E=1.5V r=2.6Ω < < 各2分
23.(16分)解析:(1)由图象知,s1=
即 ………………………………………………………………4分
………………………………………………………………4分
代入数据解得:k=62.5N/m………………………………………………………2分
(2)当s2=
 …………………………………………………………4分
…………………………………………………………4分
代入数据解得: ……………………………………………………2分
……………………………………………………2分
(3)由机械能守恒定律得: =1.8
=1.8 4 J…………………4分
4 J…………………4分
24.(18分)解析:(1)以物块为研究对象,根据牛顿第二定律可得:
 Ff1=μ2mg=ma1…………………1分
Ff1=μ2mg=ma1…………………1分
代入数据解得:a1=
以木板为研究对象,受力如图。
竖直方向合力为零,可得:F2=F1+Mg…………………1分
又有Ff2=μ
根据牛顿第二定律得:Ff1‘- Ff2=Ma2…………………1分
代入数据解得: a2=
(2)当物块滑到木板右端时,两者恰好有共同速度。…………………2分
设运动时间为t1,物块和木板运动的位移分别为s1 、s2。
根据题意得:v0-a1t1=a2t1 …………………2分
s1 -s2=L …………………2分
s1=v0t1- a1t12 …………………2分
a1t12 …………………2分
s2= a2t12 …………………2分
a2t12 …………………2分
代入数据解得:v0=
25.(20分)解析:(1)带电微粒从O点射入磁场,运动轨迹如图。
第一次经过磁场边界上的A点
由 得:
得:
 m………………2分
m………………2分
A点位置坐标(-4×10
 (2)设带电微粒在磁场中做圆周运动的周期为T
(2)设带电微粒在磁场中做圆周运动的周期为T
则t=tOA+tAC= ………………3分
………………3分
T= ……………… 2分
……………… 2分
代入数据解得:T=1.256×10-5s
所以 t=1.256×10-5s ………………1分
(3)微粒从C点沿y轴正方向进入电场,做曲线运动
 ………………2分
………………2分
 ………………2分
………………2分
 ………………2分
………………2分
代入数据解得: m………………1分
m………………1分
y= -2r=0.2-2×4×10
-2r=0.2-2×4×10
离开电、磁场时的位置坐标
(0,
26、(14分)本题答案有开放性,合理即可给分。
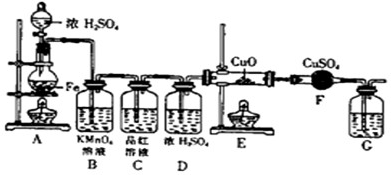
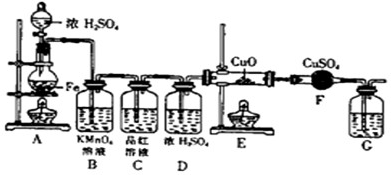
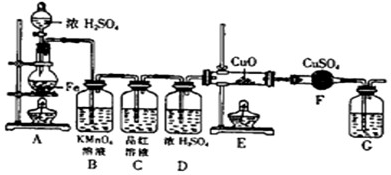
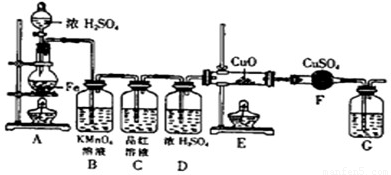
⑴①C(或Fe) ②
⑶①CaC2+2H2O=Ca(OH)2+C2H2↑ ;②麦芽糖;
⑷①Na2CO3+CO2+H2O=2NaHCO3 ;②红褐色固体。
27、(15分)
(1)6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O 6
(2)19.6 500 mL容量瓶和天平
(3)设Cu2S、CuS的物质的量分别为x、y
与Cu2S、CuS反应后剩余KMnO4的物质的量: