网址:http://m.1010jiajiao.com/timu_id_499935[举报]
1.B 2.C 3.C 4.B 5.B 6.C 7.C 8.B 9.C 10.AC 11.AD 12.D
13.B 14.A 15.B 16.D 17.B 18.B 19.D 20.D 21.C 22.C
23.(1) ;
; ;(2)HCl;
;(2)HCl; ;(3)HCl、
;(3)HCl、 、
、
24.(1) 、
、 、
、 ;(2)铁粉,Ag (3)
;(2)铁粉,Ag (3) 、
、 、
、 、
、 ;
;
25.D的式量比C大16,猜想Y是 .
. 的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
正盐A既能与强酸反应,又能跟强碱反应,且生成硫或氮的化合物,说明A是弱酸的铵盐
(1)

 (2)
(2) (3)
(3)
(4) 或
或
26.(1)Fe、C、Si、Al (2)Fe、C  、
、
 、
、
 、
、
(3)
(4)

27.(1)Mg  C
C  MgO CO (2)
MgO CO (2) Fe
Fe 



(3) ,
,

 ,
,
29.(1) (2)设金属元素的原子量为x
(2)设金属元素的原子量为x

x+16 44
 x=40,该金属元素是Ca,氧化物E的化学式是CaO
x=40,该金属元素是Ca,氧化物E的化学式是CaO
(3) ,设G的分子量为y,则
,设G的分子量为y,则 ,y=44,若G
,y=44,若G
分子中含有1个O原子,则44-16=28,28是N原子量的2倍,则G是 ,若G分子中含2个O原子,则44-32=12,则G是
,若G分子中含2个O原子,则44-32=12,则G是 ,不合题意
,不合题意
(4) ,
,
30.(1)由于向溶液中滴加盐酸,无现象,再滴加 溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
(2)



b+34 18 18
解得 b=24,∴ B是镁元素

x∶y∶z=0.01∶0.01∶0.06=l∶1∶6
∴ x=1;y=1;z=6
(3)A的原子量为 ,∴ A是钾元素
,∴ A是钾元素
A元素的名称是钾
(4)复盐的化学式为
(5)焰色反应 www.ks5u.com
www.ks5u.com
1986年,在瑞士苏黎世工作的两位科学家发现一种性能良好的金属氧化物超导体,使超导研究工作取得了突破性进展,为此两位科学家也获得了1987年度诺贝尔物理学奖,该化合物被称为苏黎世化合物.它的化学式为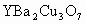 ,求:
,求:
(1)根据该化合物的化学式和化合物中正负化合价代数和为零的原则,计算其中Cu的平均化合价(已知该化合物中Y和Ba的化合价分别按+3和+2计)________;该化合物中Cu元素有+2和+3两种价态,请计算两种价态的Cu原子个数比为________.
(2)研究表明,当该化合物的组成为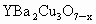 时,其超导性能最佳.这种组成是由于晶体结构中某些
时,其超导性能最佳.这种组成是由于晶体结构中某些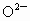 处出现空缺,形成所谓晶体缺陷.晶体缺陷导致这类化合物的组成不能用由简单整数构成的化学式表示,故被称作非整比化合物.因出现晶体缺陷后,化合物仍要保持电中性,因此,每出现一个
处出现空缺,形成所谓晶体缺陷.晶体缺陷导致这类化合物的组成不能用由简单整数构成的化学式表示,故被称作非整比化合物.因出现晶体缺陷后,化合物仍要保持电中性,因此,每出现一个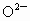 空缺,就必须减去2个正电荷,这可通过2个
空缺,就必须减去2个正电荷,这可通过2个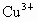 变为2个
变为2个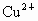 来实现,可表示为
来实现,可表示为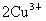
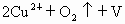 (空缺)
(空缺)
请根据化学式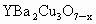 (x=0.2),计算
(x=0.2),计算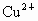 和
和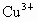 的个数比为________.
的个数比为________.
(3)超导材料电阻降为零的温度为临界温度,1987年我国科学家制成了临界温度为90K的高温超导材料.上述临界温度对应的摄氏温度为
[ ]
(4)超导现象反映了唯物辩证法三条基本规律中的________规律.
查看习题详情和答案>> 以下各物质均为中学阶段常见的物质,其中B是单质,它们的转化关系如图所示:
以下各物质均为中学阶段常见的物质,其中B是单质,它们的转化关系如图所示:(1)若反应①在常温下能进行,反应②在一定条件下进行,且A、Y为单质,X、Z为由两种元素组成的化合物,则符合此关系的有:
第一种情况:当A为金属时,则B的化学式为
第二种情况:当A为非金属且反应②为化合反应时,则X的化学式为
(2)若反应①在高温下进行,且A、Y为常见金属单质,X、Z为化合物,试写出一个符合此关系的反应②的化学方程式:
(3)若X是单质,A、Y、Z均为化合物,试写出一个符合此关系的反应①的化学方程式:
(4)若Y是单质,A、X、Z均为化合物,试写出一个符合此关系的反应①的化学方程式:
(5)若A、X、Y、Z均为化合物,且常温下X为气态,A为非气态,则符合此关系的X的化学式为
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B 与C同周期,A与D、C与F分别在同一主族,A、D两元素的原子核内的质子数之和是C、F两元素原子核内质子数之和的一半。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为______________,其分子属于___________(填“极性”、“非极性”)分子。
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氧氧化钠溶液反应的离子方程式______________________________________。
(3)一定条件下,A的气体单质与B的气体单质按n(A) : n(B)=3:1充分反应生成6.8 g气态W时放出18.44 kJ热量,则该反应的热化学方_______________________________。
(4)在10 L的密闭容器中,通入2 mol的FC2气体和3 mol C的气体单质在一定条件下反应生成FC3气体,当反应达到平衡时,单质C的浓度为0.21 mol?L-1,则平衡时FC2的转化率为__________ __。
查看习题详情和答案>>(1)写出B原子的电子式
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的结构式为
(3)写出单质E与氧氧化钠溶液反应的离子方程式
(4)一定条件下,B的最高价氧化物的水化物的浓溶液与红热的木炭反应,则该反应的化学方程式
(5)在10L的密闭容器中,通入2molFC2气体和3mol C2气体,在一定条件下反应生成FC3气体.当反应达到平衡时,C2的浓度为0.21mol?L-1,则平衡时FC2的转化率为
(1)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为__________,其分子属于__________(填“极性”或“非极性”)分子。
(2)E是非金属元素,但能表现出一些金属元素的性质,请写出单质E与氢氧化钠溶液反应的离子方程式__________________________________。
(3)一定条件下,A的气体单质与B的气体单质充分反应生成
(4)A的单质与C的单质在KOH的浓溶液中可以形成原电池,如果以M和N为惰性电极,在电极的M极通入A气体,N极通入C气体,则N极的电极反应式为________________。
(5)在
