网址:http://m.1010jiajiao.com/timu_id_499921[举报]
1.B 2.C 3.C 4.B 5.B 6.C 7.C 8.B 9.C 10.AC 11.AD 12.D
13.B 14.A 15.B 16.D 17.B 18.B 19.D 20.D 21.C 22.C
23.(1) ;
; ;(2)HCl;
;(2)HCl; ;(3)HCl、
;(3)HCl、 、
、
24.(1) 、
、 、
、 ;(2)铁粉,Ag (3)
;(2)铁粉,Ag (3) 、
、 、
、 、
、 ;
;
25.D的式量比C大16,猜想Y是 .
. 的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
正盐A既能与强酸反应,又能跟强碱反应,且生成硫或氮的化合物,说明A是弱酸的铵盐
(1)

 (2)
(2) (3)
(3)
(4) 或
或
26.(1)Fe、C、Si、Al (2)Fe、C  、
、
 、
、
 、
、
(3)
(4)

27.(1)Mg  C
C  MgO CO (2)
MgO CO (2) Fe
Fe 



(3) ,
,

 ,
,
29.(1) (2)设金属元素的原子量为x
(2)设金属元素的原子量为x

x+16 44
 x=40,该金属元素是Ca,氧化物E的化学式是CaO
x=40,该金属元素是Ca,氧化物E的化学式是CaO
(3) ,设G的分子量为y,则
,设G的分子量为y,则 ,y=44,若G
,y=44,若G
分子中含有1个O原子,则44-16=28,28是N原子量的2倍,则G是 ,若G分子中含2个O原子,则44-32=12,则G是
,若G分子中含2个O原子,则44-32=12,则G是 ,不合题意
,不合题意
(4) ,
,
30.(1)由于向溶液中滴加盐酸,无现象,再滴加 溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
(2)



b+34 18 18
解得 b=24,∴ B是镁元素

x∶y∶z=0.01∶0.01∶0.06=l∶1∶6
∴ x=1;y=1;z=6
(3)A的原子量为 ,∴ A是钾元素
,∴ A是钾元素
A元素的名称是钾
(4)复盐的化学式为
(5)焰色反应 www.ks5u.com
www.ks5u.com
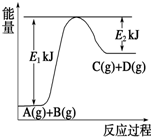 Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
Ⅰ.已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.(1)该反应是
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1
Ⅱ.已知下列热化学方程式
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H1=-25kJ?mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H2=-47kJ?mol-1 ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H3=+19kJ?mol-1③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
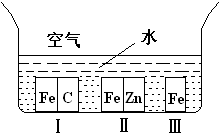 A、【供选学《化学与生活》考生作答】
A、【供选学《化学与生活》考生作答】(1)如右图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是
(2)氟氯代烷是一种破坏臭氧层的物质.在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:
①Cl+O3→ClO+O2;②O3→O+O2;③ClO→Cl+O2
上列反应的总反应式是
(3)碳酸氢钠是常见的疏松剂,主要是因为它在加热条件下产生了气体,使食品变得疏松.试写出碳酸氢钠受热分解的化学方程式
(4)垃圾资源化的方法是
A、填埋 B、焚烧 C、堆肥法 D、分类回收法
B【供选学《化学反应原理》考生作答】
设反应①Fe(s)+CO2(g)═FeO(s)+CO(g)的平衡常数为K1.反应②Fe(s)+H2O(g)═FeO(s)+H2(g)的平衡常数K2,在不同温度下,K1、K2的值如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③CO2(g)+H2(g)═CO(g)+H2O(g)写出该反应的平衡常数K3的数学表达式:K3═
(3)书写热化学方程式:
①1mol N2(g)与适量O2(g)起反应,生成NO2(g),吸收68KJ热量:
②NH3(g)燃烧生成NO2(g)和H2O(g),已知
(1)2H2(g)+O2(g)═2H2O(g)△H═-483.6kJ/mol
(2)N2(g)+2O2(g)═2NO2(g)△H═+67.8kJ/mol
1,N2(g)+3H2(g)═2NH3(g)△H═-92.0kJ/mol
NH3(g)燃烧生成NO2(g)和H2O (g)热化学方程式:
| A.(21a+189b) g | B.3(a+b) mol | C.189(a+b) g | D.(VC-d) mol |

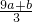 mol.
mol.