网址:http://m.1010jiajiao.com/timu_id_499900[举报]
1.B 2.C 3.C 4.B 5.B 6.C 7.C 8.B 9.C 10.AC 11.AD 12.D
13.B 14.A 15.B 16.D 17.B 18.B 19.D 20.D 21.C 22.C
23.(1) ;
; ;(2)HCl;
;(2)HCl; ;(3)HCl、
;(3)HCl、 、
、
24.(1) 、
、 、
、 ;(2)铁粉,Ag (3)
;(2)铁粉,Ag (3) 、
、 、
、 、
、 ;
;
25.D的式量比C大16,猜想Y是 .
. 的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
正盐A既能与强酸反应,又能跟强碱反应,且生成硫或氮的化合物,说明A是弱酸的铵盐
(1)

 (2)
(2) (3)
(3)
(4) 或
或
26.(1)Fe、C、Si、Al (2)Fe、C  、
、
 、
、
 、
、
(3)
(4)

27.(1)Mg  C
C  MgO CO (2)
MgO CO (2) Fe
Fe 



(3) ,
,

 ,
,
29.(1) (2)设金属元素的原子量为x
(2)设金属元素的原子量为x

x+16 44
 x=40,该金属元素是Ca,氧化物E的化学式是CaO
x=40,该金属元素是Ca,氧化物E的化学式是CaO
(3) ,设G的分子量为y,则
,设G的分子量为y,则 ,y=44,若G
,y=44,若G
分子中含有1个O原子,则44-16=28,28是N原子量的2倍,则G是 ,若G分子中含2个O原子,则44-32=12,则G是
,若G分子中含2个O原子,则44-32=12,则G是 ,不合题意
,不合题意
(4) ,
,
30.(1)由于向溶液中滴加盐酸,无现象,再滴加 溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
(2)



b+34 18 18
解得 b=24,∴ B是镁元素

x∶y∶z=0.01∶0.01∶0.06=l∶1∶6
∴ x=1;y=1;z=6
(3)A的原子量为 ,∴ A是钾元素
,∴ A是钾元素
A元素的名称是钾
(4)复盐的化学式为
(5)焰色反应 www.ks5u.com
www.ks5u.com
 Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.
Ⅰ.下列各组物质是按一定规律排列的,请将对应的排列依据填在括号内.(1)N2H4、N2O、NO、HNO2、N2O4、HNO3(
(2)CH4、C2H6、C3H8、C4H10、C5H12 (
(3)Ca、Mg、Fe、Cu、Pt (
Ⅱ. A、B、C、D、E为常见物质,已知A溶液为蓝色,B是一种碱,C是碱性氧化物,D和E为金属单质,回答:
(1)写出A、B、C的化学式:A
(2)写出下列各步的化学反应方程式:
A→B:
A→D:
Ⅲ.有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为
| ||
| ||
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为
| ||
| ||
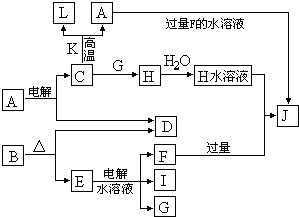
请填空:
(1)D与I能形成原子个数比为1:1的共价化合物,请写出其分子式:
G与I也能形成原子个数比为1:1的共价化合物,请写出其电子式:
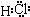
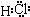
(2)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,写出电解1L1mol?L-1的E水溶液的化学方程式:
| ||
| ||
(3)化合物K 中含有组成单质L的元素,且该元素的质量分数为70%.反应C→L的化学方程式是
| ||
| ||
(4)写出A+F→J的离子方程式:
| O | 2- 4 |
| O | 2- 4 |
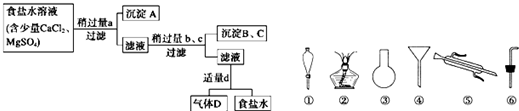
(1)沉淀A的名称是
(2)试剂d是
(3)现有下列仪器,过滤出沉淀A、B、C时必须用到
Ⅱ.海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定需要上述仪器中的一部分,则正确的是
Ⅲ.海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的
Ⅱ.已知:A为淡黄色固体,E、F、G为单质,且E、F、H为无色,I为红棕色气体,J与盐酸反应生成不溶于X的白色沉淀.

(1)D的焰色反应为黄色,则D的化学式为:
(2)写出反应①的离子反应方程式:
写出反应③的离子反应方程式:
(3)写出反应②的化学方程式:
(4)1mol C通过反应④得到1mol G,C中G的质量分数为72%,则C的化学式为:

完成下列表格:
| 序号 | 气体 | 装置连接顺序(填字母) | 制作反应的化学方程式 | ||||||
| (1) | 乙烯 | B→D→E B→D→E |
CH3-CH2-OH
CH3-CH2-OH
| ||||||
| (2) | 乙炔 | A→C→E | CaC2+2H2O=Ca(OH)2+C2H2↑ CaC2+2H2O=Ca(OH)2+C2H2↑ |
| 催化剂 |
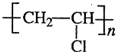 .
.| 催化剂 |
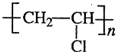 .
.