题目内容
盐酸、硝酸都是用途相当广泛的两种酸.
(1)瑞典科家舍勒在研究软锰矿(主要成份为MnO2)时,将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体.写出该反应的化学方程式,并标出电子转移方向和数目:
 .
.
(2)某校合作学习探究小组学习科学家探究精神对氯气性质进行了探究,设计了以下一些实验.
①能说明氯气与水发生化学反应的实验是
②写出实验D中所发生反应的离子方程式
(3)该校另一合作学习探究小组用下列如图1所示装置对铜与硝酸反应进行探究.
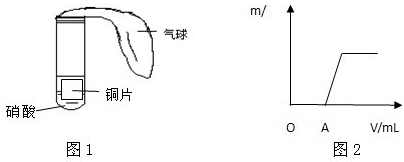
①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸,你认为他的看法正确吗?
②乙同学向反应完成后的溶液里滴加氢氧化钠溶液,产生的沉淀(m/g)和加入溶液的体积(V/mL)的关系如图2所示.请写出O-A段反应的离子方程式
(1)瑞典科家舍勒在研究软锰矿(主要成份为MnO2)时,将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体.写出该反应的化学方程式,并标出电子转移方向和数目:


(2)某校合作学习探究小组学习科学家探究精神对氯气性质进行了探究,设计了以下一些实验.
| 实验内容 | 实验现象 | |
| A | 收集一集气瓶气体,观察颜色,然后向瓶内倒入约占瓶容积1/5的蒸馏水,充分振荡. | 蒸馏水呈浅黄绿色,瓶内气体仍呈黄绿色. |
| B | 取出瓶内部分溶液,滴入紫色石蕊试液中直至过量. | 紫色石蕊试液先变红色,后红色褪色. |
| C | 取出瓶内剩下的部分溶液,滴入硝酸银溶液中. | 产生大量白色沉淀 |
| D | 最后向瓶内倒入少量浓氢氧化钠溶液,振荡. | 瓶内黄绿色气体立即消失. |
BC
BC
(填实验序号)②写出实验D中所发生反应的离子方程式
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(3)该校另一合作学习探究小组用下列如图1所示装置对铜与硝酸反应进行探究.

①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸,你认为他的看法正确吗?
不正确
不正确
.为什么?因为一氧化氮与试管内空气中的氧气反应,也会产生红棕色气体,浓硝酸和铜反应生成的是红棕色二氧化氮气体
因为一氧化氮与试管内空气中的氧气反应,也会产生红棕色气体,浓硝酸和铜反应生成的是红棕色二氧化氮气体
.甲同学还能观察到的现象有气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失
气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失
.②乙同学向反应完成后的溶液里滴加氢氧化钠溶液,产生的沉淀(m/g)和加入溶液的体积(V/mL)的关系如图2所示.请写出O-A段反应的离子方程式
H++OH-=H2O
H++OH-=H2O
.分析:(1)依据将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体是氯气书写化学方程式,依据氧化还原反应电子转移标注的转移方向和数目;
(2)①A、分析操作和现象只能说明氯气溶于水;
B、紫色石蕊试液先变红色说明生成了酸,后褪色说明生成了次氯酸,证明氯气和水发生反应;
C、氯水中滴入硝酸银溶液生成白色沉淀为氯化银,说明氯气和水发生反应生成的溶液中含氯离子;
D、实验证明氯气和氢氧化钠溶液反应;
②D中是氢氧化钠溶液和氯气的反应生成氯化钠、次氯酸钠和水;
(3)①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸不正确,因为浓硝酸和铜反应先生成红棕色气体,铜和稀硝酸反应生成的一氧化氮气体会被空气中的氧气氧化为红棕色二氧化氮气体;稀硝酸和铜反应的现象依据反应过程分析,气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失;
②OA段无沉淀生成,说明反应过程中有硝酸剩余,和氢氧化钠发生中和反应;
(2)①A、分析操作和现象只能说明氯气溶于水;
B、紫色石蕊试液先变红色说明生成了酸,后褪色说明生成了次氯酸,证明氯气和水发生反应;
C、氯水中滴入硝酸银溶液生成白色沉淀为氯化银,说明氯气和水发生反应生成的溶液中含氯离子;
D、实验证明氯气和氢氧化钠溶液反应;
②D中是氢氧化钠溶液和氯气的反应生成氯化钠、次氯酸钠和水;
(3)①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸不正确,因为浓硝酸和铜反应先生成红棕色气体,铜和稀硝酸反应生成的一氧化氮气体会被空气中的氧气氧化为红棕色二氧化氮气体;稀硝酸和铜反应的现象依据反应过程分析,气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失;
②OA段无沉淀生成,说明反应过程中有硝酸剩余,和氢氧化钠发生中和反应;
解答:解:(1)瑞典科家舍勒在研究软锰矿(主要成份为MnO2)时,将浓盐酸与软锰矿混合加热,产生了一种有刺激性气味的有色气体,是二氧化锰和浓盐酸加热反应生成氯化锰,氯气和水;反应的化学方程式为:4HCl+MnO2
MnCl2+Cl2↑+2H2O,反应中锰元素化合价从+4价变化为+2价,转移电子数为2e-;标注电子转移的化学方程式为:
故答案为:4HCl+MnO2
MnCl2+Cl2↑+2H2O, ;
;
(2)①A、分析操作和现象只能说明氯气溶于水,不能说明氯气和水反应,故A不符合;
B、紫色石蕊试液先变红色说明生成了酸,后褪色说明生成了次氯酸,证明氯气和水发生反应,故B符合;
C、氯水中滴入硝酸银溶液生成白色沉淀为氯化银,说明氯气和水发生反应生成的溶液中含氯离子,故C符合;
D、实验证明氯气和氢氧化钠溶液反应,不能说明氯气和水发生反应,故D不符合;
故答案为:B、C;
②D中是氢氧化钠溶液和氯气的反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O:
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸不正确,因为浓硝酸和铜反应先生成红棕色气体,铜和稀硝酸反应生成的一氧化氮气体会被空气中的氧气氧化为红棕色二氧化氮气体;稀硝酸和铜反应的现象依据反应过程分析,气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失;
故答案为:不正确,因为一氧化氮与试管内空气中的氧气反应,也会产生红棕色气体;气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失;
②OA段无沉淀生成,说明反应过程中有硝酸剩余,和氢氧化钠发生中和反应,反应的离子方程式为,H++OH-=H2O;
故答案为:H++OH-=H2O;
| ||

故答案为:4HCl+MnO2
| ||
 ;
;(2)①A、分析操作和现象只能说明氯气溶于水,不能说明氯气和水反应,故A不符合;
B、紫色石蕊试液先变红色说明生成了酸,后褪色说明生成了次氯酸,证明氯气和水发生反应,故B符合;
C、氯水中滴入硝酸银溶液生成白色沉淀为氯化银,说明氯气和水发生反应生成的溶液中含氯离子,故C符合;
D、实验证明氯气和氢氧化钠溶液反应,不能说明氯气和水发生反应,故D不符合;
故答案为:B、C;
②D中是氢氧化钠溶液和氯气的反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O:
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)①甲同学观察到试管中的气体由无色变成了红棕色,由此认为试管里的硝酸是浓硝酸不正确,因为浓硝酸和铜反应先生成红棕色气体,铜和稀硝酸反应生成的一氧化氮气体会被空气中的氧气氧化为红棕色二氧化氮气体;稀硝酸和铜反应的现象依据反应过程分析,气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失;
故答案为:不正确,因为一氧化氮与试管内空气中的氧气反应,也会产生红棕色气体;气球鼓起胀大,铜片上放出气泡,溶液由无色变成蓝色,铜片变小甚至消失;
②OA段无沉淀生成,说明反应过程中有硝酸剩余,和氢氧化钠发生中和反应,反应的离子方程式为,H++OH-=H2O;
故答案为:H++OH-=H2O;
点评:本题考查了制备氯气的反应原理和产物分析判断,铜与硝酸反应产物的分析理解,现象分析应用,氯气性质和硝酸性质是解题关键,

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目